
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Patlayıcı madde, hararet veya şok tesiri ile kimyasal değişikliğe uğrayan, yüksek derecede ısı, çok hacimde gaz meydana getiren, katı, sıvı veya gaz hâlindeki kimyasal maddelerdir.

Potasyum nitrat, formülü KNO3 olan bir potasyum bileşiğidir. Güherçile olarak da bilinen bileşik doğal hâlde kayaçlarda ve mağaralarda oluşan beyaz renkli kabuksu yapıda bulunur.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Nikotinamid adenin dinükleotid (NAD+) hücrelerde bulunan önemli bir koenzimdir. Elektron taşıyarak indirgenme potansiyelinin moleküller arasında aktarılmasında rol oynar.

Nikotinamid adenin dinükleotit fosfat (NADP), hücrelerde anabolik tepkimelerde, örneğin yağ asidi ve nükleik asit sentezinde, bir indirgeyici olarak kullanılır.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
Oksit, içeriğinde en az bir adet oksijen atomu ve en az bir adet başka element içeren bileşiklere verilen genel isimdir. Soy gazlar oksitleri oluşturmazlar. OF2 ve KMnO4 oksit değildir.
Biyokimyada, oksidoredüktaz, bir elektronun bir molekülden (indirgenden) bir diğerine aktarılmasını katalizleyen enzimdir. İndirgen için elektron veya hidrojen vericisi olarak da değinilir. Yükseltgen için hidrojen veya elektron alıcısı olarak da değinilir.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.

Potasyum ferrosiyanür formülü K4[Fe(CN)6] • 3H2O olan bir kimyasal bileşiktir. Potasyum ferrosiyanür metal kompleks bileşiğinin [Fe(CN)6]4− potasyum tuzudur. Bu tuz limon sarısı monoklinik kristallerden oluşmuştur.

Aktinyum(III) oksit, az görülen radyoaktif element olan aktinyumun metalik oksitlenmesiyle oluşan bir bileşiktir. Aktinyum(III) oksitin formülü Ac2O3'tür. Bu oksit aktinyum oksalatın 1000-1100 derecede kızdırılmasıyla elde edilir. Lantan(III) oksit ile benzerlik gösterir. Hegzagonal ve kristal bir yapıya sahiptir. Yükseltgenme seviyesi +3'tür. Yoğunluğu 9.2g/ml, erime noktası 1977 °C dir. Görünümü beyazdır. Bu element Ac2O (Asetik anhidrit) ile karışmamalıdır. Buradaki Ac asetil grubunda bulunmaktadır. Diğer adları aktinyum seskioksit ile diaktinyum trioksittir.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.
Permanganik asit, HMnO4 formülüne sahip bir inorganik bileşiktir. Bu güçlü oksoasit, dihidrat olarak izole edilmiştir. Permanganat tuzlarının konjugat asididir. Çok az sayıda yayın konusu olup, karakterizasyonu ve kullanımları çok sınırlıdır.
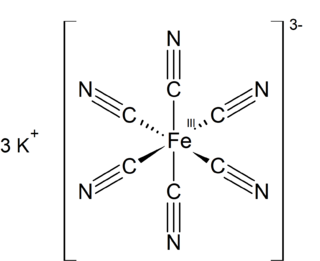
Potasyum ferrisiyanür K3[Fe(CN)6] formülü ile gösterilen inorganik bileşiktir. Bu parlak kırmızı tuz, oktahedral olarak koordine edilmiş [Fe(CN)6]3− iyonu içerir. Suda çözünür ve çözeltisi bir miktar yeşil-sarı flüoresans gösterir. 1822 yılında Leopold Gmelin tarafından keşfedilmiştir ve başlangıçta ultramarin boyalarının üretiminde kullanılmıştır.

Sodyum kromat Na2CrO4 formülüne sahip bir inorganik bileşiktir. Tetra-, hekza- ve dekahidratlar oluşturabilen sarı higroskopik bir katı olarak bulunur. Cevherlerinden krom özütlemesinde bir ara maddedir.

Sodyum bikromat Na2Cr2O7 formülüne sahip bir inorganik bileşiktir. Ancak, genellikle tuz dihidrat Na2Cr2O7•2H2O olarak kullanılır. Neredeyse tüm krom cevheri, sodyum bikromata dönüştürülerek işlenir ve neredeyse krom bazlı bütün bileşikler ve maddeler bu tuzdan hazırlanır. Reaktivite ve görünüm açısından, sodyum bikromat ve potasyum bikromat çok benzerdir. Bununla birlikte sodyum tuzu, suda potasyum tuzundan yaklaşık yirmi kat daha fazla çözünür(0 °C’de 49 g/L) ve eşdeğer ağırlığı da daha düşüktür ki bu da genellikle istenen bir durumdur.
Demir (III) klorür FeCl
3 formüllü inorganik bir bileşiktir. Kristal bir katı olmasının yanı sıra görüş açısına bağlı olarak farklı renklerle gözlemlenebilir; koyu yeşil, mor-kırmızı. Sulu formu da katı formu da fiziksel görünüm olarak koyu kahverengi rengindedir.
Fenton reaktifi kirleticileri veya atık suları oksitlemede kullanılan, katalizör olarak demir içeren bir demir bileşiği (genellikle demir (II) sülfat, FeSO4) ile hidrojen peroksitin (H2O2) bir çözeltisidir. Fenton reaktifi, trikloroetilen (TCE) ve tetrakloroetilen (perkloroetilen, PCE) gibi organik bileşikleri yok etmek için kullanılabilir. 1890'larda Henry John Horstman Fenton tarafından analitik bir reaktif olarak geliştirilmiştir.
Potasyum dikromat, K
2Cr
2O
7, çeşitli laboratuvar ve endüstriyel uygulamalarda en yaygın olarak oksitleyici madde olarak kullanılan yaygın bir inorganik kimyasal reaktiftir. Tüm altı değerlikli krom bileşiklerinde olduğu gibi sağlığa akut ve kronik olarak zararlıdır. Çok parlak, kırmızı-turuncu renge sahip kristal iyonik bir katıdır. Bu tuz, endüstriyel açıdan daha uygun olan sodyum dikromat tuzunun aksine, nemden arındırılmadığı için laboratuvarlarda popülerdir.














