
Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.
Bant teorisi, bir katıdaki elektronların davranışını tanımlar. Bu teoriye göre katıda elektronlar tarafından doldurulacak sürekli enerji bantları ve elektronların bulunamayacağı enerji aralıkları bulunur. Teori elektriksel direnç ve optik absorpsiyon gibi birçok olayı açıklamada büyük yarar sağlar.

Benzen, aren veya aromatik hidrokarbonlar olarak adlandırılan organik bileşikler sınıfının en basit üyesidir. Renksiz, yanıcı, kaynama noktası 80,1 °C, erime noktası 5,5 °C olan bir sıvıdır. Moleküler formülü C6H6'dır. Benzen, endüstriyel bakımdan değerli olduğu gibi yapısı bakımından da kimya çalışmalarında önemlidir. Kan hücrelerini öldürme etkisi olduğundan kanser yapıcı bileşikler arasına girer.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Metalik bağ, esas olarak metaller arasındaki, bir ya da daha çok atomu bir arada tutan bir kimyasal bağ türüdür. Metal atomlarının latisindeki serbest elektronların yer değiştirmiş olarak paylaşılması esasına dayanır. Metalik bağ, kovalent bağ ve iyonik bağ ile birlikte üç güçlü etkileşimden (bağ) biridir. Kimyasal bir etkileşimdir.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Koordine kovalent bağ, ametal-ligand arasındaki bağın, sadece ligand üzerindeki elektronlar ile oluşması durumunda oluşan kovalent bağ türü. Elektron ortaklaşması göstermemektedir.

Kimyada istiflenme, genelde aromatik olan moleküllerin atomlar arası etkileşerek deste şeklinde üst üst üste gelmesidir. İstiflenmiş bir sistemin en yaygın bilinen örneği DNA molekülünde birbirini takibeden bazlarda görülür. İstiflenme proteinlerde, non-polar iki halkanın örtüşmesi halinde de meydana gelir. Hangi moleküllerarası kuvvetlerin istiflenmeye neden olduğu hâlen tartışma konusudur.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.

Grafen, karbon atomunun bal peteği örgülü yapılarından bir tanesine verilen isimdir.
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.
Hesaplamalı kimya, kimya problemlerini çözmeye yardımcı olmak için bilgisayar simülasyonunu kullanan bir kimya dalıdır. Moleküllerin, katıların yapı ve özelliklerini hesaplamak için verimli bilgisayar programlarına dahil edilmiş teorik kimya yöntemlerini kullanır. Bu yöntemlerin kullanılmasının nedeni, hidrojen moleküler iyonu ile ilgili nispeten yeni sonuçlar dışında, kuantum çok-gövdeli(many-body) problemlerin analitik olarak çözülemez oluşudur. Hesaplama sonuçları normal olarak kimyasal deneylerle elde edilen bilgileri tamamlarken, bazı durumlarda gözlemlenmeyen kimyasal olayları da tahmin edebilmektedir. Yeni ilaç ve materyallerin tasarımında yaygın olarak kullanılmaktadır.

Kimyada, doğrusal moleküler geometri 180°'lik bir açıya yerleştirilmiş diğer iki atoma bağlanmış merkezi bir atom etrafındaki geometriyi tarif eder. Asetilen (HC≡CH) gibi doğrusal organik moleküller genellikle karbon merkezleri için sp orbital hibridizasyonu teşvik edilerek tarif edilir.
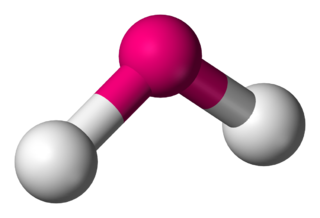
Kimyada, " açısal" ya da "bükülmüş" terimi bazı moleküllere moleküler geometrilerini tanımlamak için kullanılabilir. Oksijen gibi bazı atomlar, Elektron dizilimi nedeniyle hemen hemen her zaman iki (veya daha fazla) kovalent bağını doğrusal olmayan yönlerde ayarlarlar. Su (H2O), analoglarının yanı sıra açısal bir molekül örneğidir. İki hidrojen atomu arasındaki bağ açısı yaklaşık olarak 104,45°'dir. Doğrusal olmayan geometri genel olarak sadece ana grup elementleri içeren diğer üç atomlu molekülleri ve iyonlar için gözlemlenir, belirgin örnekler: Azot dioksit (NO2), kükürt diklorür (SCL2) ve metilen (CH2).
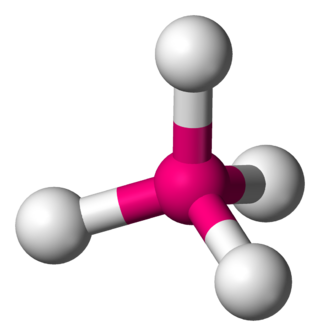
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Kimyada ikili bağ veya çift bağ, iki atom arasında, tekli bağdaki iki elektrona karşılık dört bağ elektronu içeren kovalent bir bağdır. İkili bağlar en yaygın olarak iki karbon atomu arasında, örneğin alkenlerde meydana gelir. Birçok ikili bağ iki farklı element arasında bulunur: örneğin, bir karbon atomu ile bir oksijen atomu arasındaki bir karbonil grubunda. Diğer yaygın ikili bağlar azo bileşiklerinde (N=N), iminlerde (C=N) ve sülfoksitlerde (S=O) bulunur. Bir iskelet formülünde, bir ikili bağ, bağlı iki atom arasında iki paralel çizgi (=) olarak çizilir; tipografik olarak bunun için eşittir işareti kullanılır. İkili bağlar kimyasal gösterimde Rus kimyager Alexander Butlerov tarafından tanıtılmıştır.
















