Voltametri

Voltametri, analitik kimyada ve çeşitli endüstriyel işlemlerde kullanılan elektroanalitik yöntemlerin bir altdalıdır. Voltametride, potansiyel değiştirilirken buna bağlı olarak değişen akımın ölçülmesi ile analit hakkında bilgi elde edilir.[1][2] Voltametrik bir deney için analitik veriler, analit tarafından üretilen akımı, çalışma elektrodunun potansiyeline karşı çizilmesi ile voltamogram denilen biçimde elde edilir.[3]
Üç elektrot sistemi

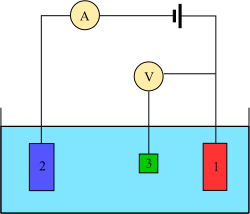
Voltametri deneyleri bir analitin yarı hücre etkinliğini araştırır. Voltametri, uygulanan potansiyelin bir fonksiyonu olarak akımın incelenmesidir. Bu eğrilere I = f (E) voltamogram denir. Potansiyel keyfi olarak adım adım veya sürekli olarak değiştirilir ve gerçek akım değeri bağımlı değişken olarak ölçülür. Bunun tersi olan amperometri de mümkündür, ancak voltametri kadar yaygın değildir. Eğrilerin şekli, potansiyel değişimin hızına (itici gücün doğası) ve çözeltinin karıştırılıp karıştırılmamasına veya hareketsiz kalmasına (kütle aktarımı) bağlıdır. Çoğu deneyde, elde edilen akım (amper ) ölçülürken bu sırada analit ile temas eden bir elektrodun potansiyeli (volt ) kontrol edilir.[4]
Voltametri deneyi yapmak için en az iki elektrot gerekir. Analit ile temas eden çalışma elektrodu, istenen potansiyeli kontrollü bir şekilde uygulamalı ve devreden geçen yükün analite ve analitten devreye transferini kolaylaştırmalıdır. İkinci bir elektrot, hücrenin diğer yarısı gibi davranır. Bu ikinci elektrot, çalışma elektrodunun potansiyelini ölçmek için bilinen bir potansiyele sahip olmalıdır, ayrıca çalışma elektrodu tarafından giren veya çıkan yükü dengelemelidir. Bu düzenek uygun bir kurulum olsa da, bir takım eksiklikleri vardır. En önemlisi, bir elektrodun, çalışma elektrodundaki karşı indirgenme olaylarına bağlı akım geçişi gerçekleşirken sabit bir potansiyeli sürdürmesi son derece zordur.
Bu sorunu çözmek için, elektron sağlama ve bir referans potansiyeli oluşturma işlemleri iki ayrı elektrot arasında bölünür. Referans elektrot, bilinen bir indirgeme potansiyeline sahip bir yarım hücredir. Tek rolü, çalışan elektrotun potansiyelini ölçmek ve kontrol etmek için referans olarak hareket etmektir ve hiçbir noktasından herhangi bir akım geçmez. Bu sırada Yardımcı elektrot, çalışan elektrotta gözlemlenen akımı dengelemek için gereken tüm akımı geçirir. Bu akımı elde etmek için, yardımcı elektrod genellikle çözücü penceresinin kenarlarındaki aşırı potansiyele salınır, burada çözücü veya destekleyici elektroliti oksitler veya azaltır. Bu elektrotlar, çalışma, referans ve yardımcı modern üç elektrot sistemini oluşturur.
Daha fazla elektroda sahip birçok sistem vardır, ancak tasarım prensipleri genellikle üç elektrot sistemiyle aynıdır. Örneğin, döner halka disk elektrot, potansiyelleri birbirinden bağımsız olarak taramak veya tutmak için kullanılabilen iki farklı ve ayrı çalışma elektroduna, bir diske ve bir halkaya sahiptir. Bu elektrotların her ikisi de toplam dört elektrot tasarımı için tek bir referans ve yardımcı kombinasyon ile dengelenir. Daha karmaşık deneyler, gerektiğinde ve bazen referans veya yardımcı elektrotlar gibi çalışan elektrotlar ekleyebilir.
Uygulamada, bilinen boyutlara ve yüzey özelliklerine sahip çalışan bir elektrotun olması önemli olabilir. Sonuç olarak, çalışma elektrotları düzenli olarak temizlemek ve cilalamak yaygındır. Yardımcı elektrodun materyali, analit çözeltisi içeriği ile reaksiyona girmediği ve iyi iletken olduğu sürece hemen hemen her şey olabilir. Cıvanın çalışma elektrotu olarak kullanılması yaygındır (veya?) DME ve HMDE ve ayrıca yardımcı olarak ve voltametri yöntemi polarografi olarak bilinir. Referans, üç elektrodun en kompleksidir; kullanılan çeşitli standartları vardır ve başka bir yerde araştırmaya değer. Sulu olmayan çalışmalar için, IUPAC, ferrocene / ferrocenium çiftinin dahili bir standart olarak kullanılmasını önerir. Voltametri deneylerinin çoğunda, çözelti direncini en aza indirmek için bir yığın elektrolit (destekleyici elektrolit olarak da bilinir) kullanılır. Toplu bir elektrolit olmadan bir deney yapmak mümkündür, ancak eklenen direnç sonuçların doğruluğunu büyük ölçüde azaltır. Oda sıcaklığında iyonik sıvılar ile, çözücü elektrolit görevi görebilir.
Teori
Veri analizi, voltametrinin zamansal bileşeni nedeniyle termodinamiğe ek olarak kinetiklerin de dikkate alınmasını gerektirir. Nernst denklemi gibi idealize edilmiş teorik elektrokimyasal termodinamik ilişkiler bir zaman bileşeni olmadan modellenmiştir. Bu modeller voltametrinin dinamik yönlerini tanımlamak için tek başına yeterli olmasa da, Tafel denklemi ve Butler-Volmer denklemi gibi modeller teoriyi gözlemlenen sonuçlarla ilişkilendiren değiştirilmiş voltametri ilişkilerinin temelini atmaktadır.
Voltametri türleri
- Doğrusal tarama voltametrisi
- Merdiven voltametrisi
- Kare dalga voltametrisi
- Döngüsel voltametri - Difüzyon katsayılarını ve yarı hücre azaltma potansiyelini belirlemek için kullanılabilecek voltametrik bir yöntemdir.
- Anodik sıyırma voltametrisi - Metal katyonlarının iz analizi için kantitatif, analitik bir yöntem. Analit, bir bırakma basamağı sırasında çalışan elektrot üzerine biriktirilir (elektroliz edilir ) ve daha sonra sıyırma basamağı sırasında oksitlenir. Akım, sıyırma adımı sırasında ölçülür.
- Katodik sıyırma voltametrisi - Anyonların eser analizinde kantitatif, analitik bir yöntem. Cıva elektrodunu oksitleyen ve anyonların çözünmeyen çökeltilerini oluşturan pozitif bir potansiyel uygulanır. Negatif bir potansiyel daha sonra biriken filmi çözeltiye indirir (şeritler).
- Adsorptif sıyırma voltametrisi - İz analizi için kantitatif, analitik bir yöntem. Analit sadece elektrot yüzeyinde adsorpsiyonla (yani elektroliz olmadan) biriktirilir, daha sonra analitik sinyal vermek için elektrolize edilir. Kimyasal olarak modifiye edilmiş elektrotlar sıklıkla kullanılır.
- Alternatif akım voltametrisi
- Polarografi - çalışma elektrodunun geniş bir katodik aralığı ve yenilenebilir yüzeyi için yararlı olan bir düşme cıva elektrodu (DME) olduğu bir voltametri alt sınıfı.
- Döndürülmüş elektrot voltametri - bir hidrodinamik teknik çalışma ki burada elektrot, genellikle bir döner disk elektrot (RDE) ya da halka disk elektrot döner (RRDE), çok yüksek bir hızda döndürülür. Bu teknik, yarım reaksiyon için kinetikleri ve elektrokimyasal reaksiyon mekanizmasını incelemek için yararlıdır.
- Normal nabız voltametrisi
- Diferansiyel nabız voltametrisi
- kronoamperometri
Tarih
Voltametrinin başlangıcı 1922'de Nobel Ödülü kazanan kimyager Jaroslav Heyrovský tarafından polarografinin keşfi ile kolaylaştırıldı. Erken voltametrik tekniklerin, analitik kimyada günlük kullanım için uygulanabilirliklerini sınırlayan birçok sorunu vardı. Polarografide bu problemler, cıvanın +0.2'den daha pozitif bir potansiyelde okside olduğu gerçeğini içeriyordu, bu da potansiyelin pozitif bölgesindeki analitlerin sonuçlarını analiz etmeyi zorlaştırmaktadır. Başka bir sorun, elektrot yüzeyinin büyük kapasitansının yüklenmesinden elde edilen artık akımı içerir.[5] Heyrovsky, 1922'de uygulanan potansiyel üzerine düşen cıva elektrodundan akan akıma ilk bağımlılığı ilk kaydettiğinde, noktadan noktaya ölçümler yaptı ve bir akım-voltaj eğrisi çizdi. Bu ilk polarogram olarak kabul edildi. Bu süreci kolaylaştırmak için, M. Shikata ile şimdi bir polarograf olarak bilinen şeyi inşa etti ve birkaç saat içinde aynı eğriyi fotoğrafsal olarak kaydetmesini sağladı. Potansiyelin ve kontrolünün önemini kabul etti ve sınırlayıcı akımları ölçme fırsatlarını da tanıdı. Ayrıca modern bir araç olarak cıva elektrodunu düşürmenin önemli bir parçasıydı.
1942'de Archie Hickling, elektrokimya alanında bir ilerleme olan ilk üç elektrot potansiyostatını inşa etti. Bu potansiyostatı bir elektrodun voltajını kontrol etmek için kullandı. Bu arada, 1940'ların sonlarında Kenneth Cole, voltaj kelepçesi olarak adlandırdığı elektronik bir devre icat etti. Gerilim kelepçesi sinirlerdeki iyonik iletimi analiz etmek için kullanıldı.
1960'lar ve 1970'ler, bilgisayar eklenmiş ve kontrollü sistemlerin teorisi, enstrümantasyonu ve tanıtımında birçok ilerleme gördü. Cıva elektrotlarında modern polarografik ve voltametrik yöntemler üç bölümde ortaya çıkmıştır.
İlk bölüm cıva elektrotlarının gelişimini içerir. Aşağıdaki elektrotlar üretildi: damlayan cıva elektrodu, cıva buharlama elektrodu, asılı cıva damla elektrodu, statik cıva damla elektrodu, cıva film elektrodu, cıva amalgam elektrotları, cıva mikroelektrotları, kimyasal olarak değiştirilmiş cıva elektrotları, kontrollü büyüme cıva elektrotları ve büzülebilir cıva damla elektrotları .
Kullanılan ölçüm tekniklerinde de bir ilerleme oldu. Bu ölçüm teknikleri şunları içerir: : klasik DC polarografi, osilopolarografi, Kalouşsek'in değiştiricisi, AC polarografisi, tat polarografisi, normal nabız polarografisi, diferansiyel nabız polarografisi, kare dalga voltametrisi, döngüsel voltametri, anodik sıyırma voltametrisi, konveksiyon teknikleri ve eliminasyon yöntemleri.
Son olarak, cıva elektrotlarının hassasiyetini arttıran ön konsantrasyon tekniklerinde de bir ilerleme olmuştur. Bu, anodik sıyırma voltametrisi, katodik sıyırma voltametrisi ve adsorptif sıyırma voltametrisinin gelişmesiyle ortaya çıktı.
Bu gelişmeler hassasiyeti artırdı ve endüstrinin rutin analitik çalışmada etkili bir şekilde kullanılabilecek daha ucuz potansiyostat, elektrotlar ve hücrelerin üretimine yanıt vermesini sağlayan yeni analitik yöntemler yarattı.
Endüstride ve araştırmayla ilgilenen belirli türlerin belirlenmesi için ticari olarak bir dizi voltametrik sistem üretilmektedir. Bu cihazlar bazen elektrotlar olarak adlandırılır, ancak aslında tam voltametrik hücrelerdir ve daha iyi sensörler olarak adlandırılır. Bu sensörler, çeşitli matrislerdeki çeşitli organik ve inorganik analitlerin analizi için kullanılabilir.
Oksijen elektrodu
Deniz suyu, kan, kanalizasyon, kimyasal bitkilerden ve topraktan kaynaklanan çeşitli sulu ortamlarda çözünmüş oksijenin belirlenmesi endüstri, biyomedikal ve çevresel araştırmalar ve klinik tıp için büyük önem taşımaktadır. Bu tür ölçümleri yapmak için en yaygın ve kullanışlı yöntemlerden biri, 1956'da LC Clark, Jr. tarafından patentli Clark oksijen sensörüdür .
Ayrıca bakınız
- Neopolarogram
Kaynakça
- ^ Peter Kissinger; William R. Heineman (23 Ocak 1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded (İngilizce). CRC Press. ISBN 0-8247-9445-1.
- ^ Cynthia G. Zoski (2007). Handbook of Electrochemistry (İngilizce). Elsevier. ISBN 0-444-51958-0.
- ^ Daniel C. Harris (29 Mayıs 2015). Quantitative Chemical Analysis (İngilizce). W. H. Freeman. ISBN 978-1-4641-3538-5.
- ^ Allen J. Bard; Larry R. Faulkner (18 Aralık 2000). Electrochemical Methods (İngilizce). Wiley. ISBN 0-471-04372-9.
- ^ Kounaves, Samuel. "Voltammetric Techniques". Tufts University Department of Chemistry
Konuyla ilgili yayınlar
- Reinmuth, W. H. (1961-11-01). "Theory of Stationary Electrode Polarography". Analytical Chemistry. 33 (12): 1793–1794. doi:10.1021/ac60180a004.
- Douglas A. Skoog; Donald M. West; F. James Holler (1996). Fundamentals of Analytical Chemistry (İngilizce). Saunders College Pub. ISBN 0-03-005938-0.
- Piero Zanello (2003). Inorganic Electrochemistry (İngilizce). Royal Society of Chemistry. ISBN 0-85404-661-5.
- https://web.archive.org/web/20061020175748/http://new.ametek.com/content-manager/files/PAR/App%20Note%20E-4%20-%20Electrochemical%20Analysis%20Techniques1.pdf
- [1]













