Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.
Fermiyon, parçacık fiziğinde, Fermi-Dirac istatistiğine uyan parçacıktır. Başka bir deyişle, Enrico Fermi ve Paul Dirac'ın gösterdiği üzere, Bose-Einstein istatistiğine sahip bozonların aksine fermiyonlar, belirtilen zamanda sadece bir kuantum durumuna karşılık gelebilen parçacıklardır. Eğer iki ayrı fermiyon uzayda aynı yerde tanımlanmışsa her bir fermiyonun özelliği birbirinden farklı olmak zorundadır. Örnek olarak, iki elektron bir çekirdeğin etrafında aynı orbitalde bulunacaklarsa, bu kez aynı spin durumunda olamazlar ve her orbitalde elektronun biri yukarı diğeri aşağı spin durumundadır.
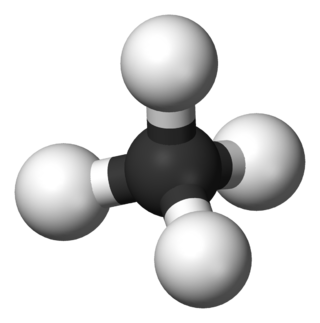
Hidrokarbon, sadece karbon ve hidrojen atomlarından oluşan kimyasal bileşiklerin genel adı.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.
Ametal, metal özelliği göstermeyen elementlerdir. Isıyı ve elektrik akımını iletmek gibi metallere özgü özellikleri göstermezler. Ayrıca kendi aralarındaki ortak özellikleri yok denecek kadar azdır. Genellikle karbon, azot, fosfor, oksijen, kükürt, selenyum, flor, klor, brom, iyot ve soy gaz elementlerine ametal denir.
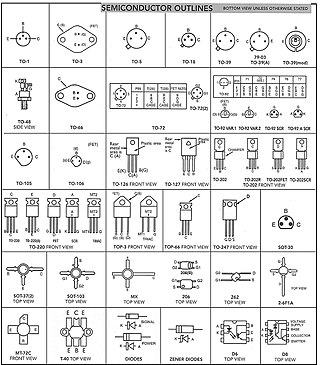
Yarı iletken üzerine yapılan mekanik işin etkisiyle iletken özelliği kazanabilen, normal şartlar altında yalıtkan olan maddelerdir.

Karbonmonoksit, CO formülüne sahip sadece bir karbon ve bir oksijen atomundan oluşan inorganik bileşiktir Karbonmonoksitte karbon ve oksijen arasında üçlü bağ vardır. Endüstride jeneratör gazı, su gazı, kuvvet gazı ve hava gazı içinde kullanılır. Yakıt olarak da kullanılmaktadır.

Tungsten veya diğer adıyla volfram, atom numarası 74, atom ağırlığı 183,85 olan ve kimyasal simgesi W ile gösterilen, yoğunluğu 19,3 g/cm³ olan, 3482 °C'de eriyebilen kimyasal bir elementtir. Çok sert, ağır, çelik gri ya da beyaz renkte geçiş metallerinden biri olan tungsten, wolframite ve scheelite içeren madenlerde bulunur. Tungsten, sağlam fiziksel yapısı ve yüksek erime sıcaklığı olan önemli bir maddedir. Erime sıcaklığı en yüksek olan metaldir. Saf haliyle bazı elektronik uygulamalarda kullanılır, ancak çoğunlukla bileşik ya da alaşım olarak, diğer metallerin işlenmesi veya madencilik gibi uygulamalarda malzeme dayanımı gerektiren ekipmanlarda, ampullerin lamba tellerinde, X ışını cihazlarında ve uzay teknolojisi yüksek performans alaşımlarında kullanılır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

Vanadyum, simgesi V, atom numarası 23 olan bir elementtir. Bir geçiş metali olan element, doğada nadiren bulunur. Yapay olarak izole edildiğinde, oksit bir katmanın ortaya çıkmasıyla pasifleşir ve kararlı hâle gelen elementin oksitlenmesi sona erer.

Neon (Ne), periyodik tablonun 8-A grubunda yer alan soy gazdır. Atom numarası 10'dur.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Eksicik yakalanması, atom çekirdeğinde yüksek sayıda proton ve pozitron yayımına yetecek kadar erkenin bulunmadığı izotoplar için bir çözünme kipidir.
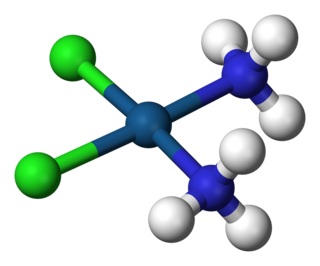
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.
Yükseltgenme seviyesi ya da oksidasyon seviyesi, bir atomun reaksiyon sırasındaki elektron değişimini ifade eder. Element hâlde yükseltgenme basamağı sıfır kabul edilir. Reaksiyon sırasında aldığı her elektron yükseltgenme basamağını 1 düşürür, verdiği elektron ise basamağı yükseltir. Fe3O4 gibi bileşiklerde verilen ya da alınan toplam elektronlar atomlara bölüştürülür. Yükseltgenme basamağı kuantize değildir. Burada elektronlar bölünüp atomlara dağıtılmaz, 3 demir atomunda ortaklaşa kullanılır.

Yükseltgen madde bir yükseltgenme-indirgenme (redoks) reaksiyonunda başka bir türden bir elektron alan element ya da bileşiktir. Yükseltgen maddelerin elektron kazandıklarından dolayı indirgendikleri söylenebilir.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.

Vanadyum triklorür, VCl3 formülüne sahip inorganik bileşiktir. Bu mor tuz, diğer vanadyum (III) komplekslerinin ortak öncüsüdür.













