Vanadyum
 Farklı dokulardaki %99 saflıktaki üç vanadyum kristal çubuğu ile %99,95 saflıktaki 1 cm3 hacmindeki bir vanadyum küpü | ||||||||||||||||||||||||||||
| Görünüş | Mavi-gri metal | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Standart atom ağırlığı Ar, std(V) | 50,9415(1) | |||||||||||||||||||||||||||
| Periyodik tablodaki yeri | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Atom numarası (Z) | 23 | |||||||||||||||||||||||||||
| Grup | 5. grup | |||||||||||||||||||||||||||
| Periyot | 4. periyot | |||||||||||||||||||||||||||
| Blok | d bloku | |||||||||||||||||||||||||||
| Elektron dizilimi | [Ar] 3d3 4s2 | |||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 11, 2 | |||||||||||||||||||||||||||
| Fiziksel özellikler | ||||||||||||||||||||||||||||
| Faz (SSB'de) | Katı | |||||||||||||||||||||||||||
| Erime noktası | 2183-2208 K (1910-1935 °C, 3470-3515 °F) | |||||||||||||||||||||||||||
| Kaynama noktası | 3680 K (3407 °C; 6164,6 °F) | |||||||||||||||||||||||||||
| Yoğunluk (OS) | 6,0-6,11 g/cm3 | |||||||||||||||||||||||||||
| sıvıyken (en'de) | 5,5 g/cm3 | |||||||||||||||||||||||||||
| Erime entalpisi | 21,5±3 kJ/mol | |||||||||||||||||||||||||||
| Buharlaşma entalpisi | 465,9 kJ/mol | |||||||||||||||||||||||||||
| Molar ısı kapasitesi | 24,89 J/(mol·K) | |||||||||||||||||||||||||||
Buhar basıncı
| ||||||||||||||||||||||||||||
| Atom özellikleri | ||||||||||||||||||||||||||||
| Yükseltgenme durumları | -3, -1, 0, +1, +2, +3, +4, +5 (amfoter oksit) | |||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1,63 | |||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||||||||||
| Atom yarıçapı | Deneysel: 134 pm | |||||||||||||||||||||||||||
| Kovalent yarıçapı | 153±8 pm | |||||||||||||||||||||||||||
| Diğer özellikleri | ||||||||||||||||||||||||||||
| Kristal yapı | Hacim merkezli kübik (hmk) | |||||||||||||||||||||||||||
| Ses hızı çubukta | 4560 m/s (20 °C'de) | |||||||||||||||||||||||||||
| Genleşme | 8,4 µm/(m·K) | |||||||||||||||||||||||||||
| Isı iletkenliği | 30,7 W/(m·K) | |||||||||||||||||||||||||||
| Elektrik direnci | 197 Ω·m | |||||||||||||||||||||||||||
| Manyetik düzen | Paramanyetik | |||||||||||||||||||||||||||
| Manyetik alınganlık | +255,0 × 10-6 cm3/mol | |||||||||||||||||||||||||||
| Young modülü | 128 GPa | |||||||||||||||||||||||||||
| Kayma modülü | 47 GPa | |||||||||||||||||||||||||||
| Hacim modülü | 160 GPa | |||||||||||||||||||||||||||
| Poisson oranı | 0,35 | |||||||||||||||||||||||||||
| Mohs sertliği | 6,7 | |||||||||||||||||||||||||||
| Vickers sertliği | 628-640 MPa | |||||||||||||||||||||||||||
| Brinell sertliği | 600-742 MPa | |||||||||||||||||||||||||||
| CAS Numarası | 7440-62-2 | |||||||||||||||||||||||||||
| Tarihi | ||||||||||||||||||||||||||||
| Adını aldığı | Vanadís | |||||||||||||||||||||||||||
| Keşif | Andrés Manuel del Río (1801) | |||||||||||||||||||||||||||
| İlk izolasyon | Henry Roscoe (1867) | |||||||||||||||||||||||||||
| Adlandıran | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||
| Ana izotopları | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Vanadyum, simgesi V, atom numarası 23 olan bir elementtir. Bir geçiş metali olan element, doğada nadiren bulunur. Yapay olarak izole edildiğinde, oksit bir katmanın ortaya çıkmasıyla pasifleşir ve kararlı hâle gelen elementin oksitlenmesi sona erer.
Andrés Manuel del Río tarafından 1801 yılında vanadinit mineralinin (Pb5(VO4)3Cl) analizi sırasında keşfedildi ve erythronium adı verildi. Ancak bir süre sonra erythronium ile kromun aslında aynı element oldukları fikri kabul gördü. 1831 yılında Nils Gabriel Sefström, vanadyumun keşfedilmemiş bir element olduğunu ispatlayarak elemente, İskandinav güzellik ve bereket tanrıçası Vanadis'in (Freyja olarak da bilinir) adını verdi. Henry Roscoe ise 1867'de vanadyumu izole etti.
Element, doğadaki yaklaşık 65 mineral ile fosil yakıt rezervlerinde bulunur. Çin ve Rusya'da çelik üretiminde ortaya çıkan cürufun işlenmesi ile üretilir. Diğer ülkelerde ise direkt olarak manyetitten, ağır petrolün oluşturduğu baca tozunun geridönüşümü ya da uranyum madenciliğinin bir yan ürünü olarak elde edilir. Elementin en yaygın kullanımı alaşımlı çelik endüstrisindedir. Vanadyum redoks pili üretimi de zamanla artış gösterir. Endüstriyel açıdan en çok kullanan vanadyum bileşiği olan vanadyum pentoksit (V2O5), sülfürik asit üretimi sırasında bir katalizör işlevi görür. Çoğu canlıda bulunan vanadyum, bazı enzimlerin aktif bölgesi olarak kullanılır.
Tarihi
Keşfi ve adlandırılması
1801'de Andrés Manuel del Río ile iki yardımcısı, Meksika'nın Hidalgo eyaletindeki Zimapán yakınlarındaki Purisima del Cardonal madeninde "boz kurşun" (daha sonraları vanadinit olarak adlandırıldı) örneği buldu. Örnek üzerinde gerçekleştirdiği birtakım çalışmalar sonrasında del Río, yeni bir element keşfettiğini duyurdu. İlk olarak; oksitleri, çözeltileri, tuzları ve çökeltilerinin çeşitli renkler taşıdığını gözlemlediği elementi, Yunancada "tüm renkler" anlamı taşıyan παγχρώμιο (panhromio) kelimesinden türetilen pankromyum şeklinde adlandırdı. Ancak sonrasında, tuzların asitle ısıtıldığında kırmızı renk almasından ötürü elemente, Yunancada "kırmızı" anlamına gelen ερυθρός (erutrhos) kelimesinden türettiği erithronyum adını verdi. Elementin keşfine dair ilk haber, 1802'de yayımlandı.[1]
Del Río, Nisan 1803'te Meksiko'ya gelen ve Freiberg Madencilik Akademisinde birlikte öğrenim gördüğü Alexander von Humboldt'a, elde ettiği bu elementten bahsetti. Von Humboldt, del Río'nun verdiği bilgilere göre bu elementin, 1797'de keşfedilen krom ya da 1789'da keşfedilen uranyum olabileceğini öne sürdü. O dönemlerde kromun detaylı tanımı Meksika'ya ulaşmamıştı. Von Humboldt'un anlattıkları ve ülkeye getirdiği Antoine-François de Fourcroy'un Systeme des connaissances chimiques adlı kitabın beşinci cildinde okuduklarından sonra, keşfettiğini söylediği elementin krom olduğuna ikna olan del Río, 1804'te yayımladığı ve çalışmalarını anlattığı makalesinde, elde ettiği elementin krom olduğunu yazdı.[1][2]
Avrupa'ya dönüşü esnasında von Humboldt, hem "boz kurşun" örneklerini hem de del Río'nun çalışmasının Fransızca bir kopyasını da yanında götürdü. Ağustos 1804'te Paris'e ulaştıktan sonra bunları Hippolyte-Victor Collet-Descotils'e verdi. Örnek üzerinde gerçekleştirdiği analizleri ardından 1805'te yayımladığı makalesinde Collet-Descotils, ortaya çıkan elementin krom olduğunu belirtti.[1][3] Del Río'nun analiz sonuçlarını bir makale olarak yayımlamayan von Humboldt, Collet-Descotils'in çalışmasını del Río'ya da gönderdi.[1]
İsveç'in Småland ilindeki Taberg yakınlarından elde ettiği bir demir cevheri örneğinde bulduğu oksitte (vanadyum pentoksit, V2O5), krom ya da uranyuma benzer davranışlar sergilese de yeni bir element ortaya çıktığını düşünen Nils Gabriel Sefström, analizi kontrol etmesi için oksit örneğini Jacob Berzelius'a da verdi. Berzelius'un kontrolünün ardından 1831'de yayımladığı makaleyle Sefström, yeni bir element keşfettiğini duyurdu. Daha önce hiçbir elementin ilk harfi olarak kullanılmayan V harfiyle başlayan bir isim arayışına giren Sefström, elementin meydana getirdiği "güzel renkli" tuz ve çözeltilere atfen, İskandinav mitolojisideki güzellik ve bereket tanrıçası Vanadís'ten türettiği vanadyum isminde karar kıldı.[4] Bu keşfi öğrenen Friedrich Wöhler de, von Humboldt'un daha önceleri kendisine verdiği "boz kurşun" örneği üzerinde çalışmalar sürdürdü. Berzelius'un, Sefström'ün elde ettiği elementten gönderdiği örnekle von Humboldt'tan aldığını karşılaştıran Wöhler, yılın ilerleyen dönemlerinde bu iki elementin aynı olduğunu doğruladı.[1][5] Von Humboldt, Fransız Bilimler Akademisinin 2 Şubat 1831 tarihli oturumunda elementin keşfi için del Río, Sefström ve Wöhler'e eşit pay verdi.[1][5]
1831'de George William Featherstonhaugh, elementin ilk bulunduğu yer olan Zimapán'a atfen "zimapanyum" ya da del Río'ya atfen "riyum" ya da "riyonyum" olarak adlandırılabileceğini yazsa da bu öneri kabul görmedi.[6] Del Río, 1832'de yayımlanan kitabı Elementos de Orictognosía'nın ikinci baskısında şu ifadeleri kullandı:[1]
[Humboldt] Meksika'dan ayrıldığında, yayımlayabileceğini düşünerek çalışmalarımın Fansızca bir kopyasını ... verdim. İnsanların dikkatini çekecek değerde olduklarını düşünseydi ... yeni bir metalin keşfi otuz yıl gecikmezdi.
İzolasyonu, eldesi ve kullanım geçmişi
Başka elementlerle birlikte bulunmasından ötürü, keşfinin ilk dönemlerinde vanadyumun izole edilmesi konusunda birtakım zorluklar yaşanıyordu.[7] 1831'de Jacob Berzelius elementi ürettiğini kaydetse de Henry Roscoe, elde edilenin vanadyum nitrür (VN) olduğunu gösterdi. 1867'de Roscoe, vanadyum(II) klorürü (VCl2) hidrojen (H) ile indirgeyerek elementi toz şeklinde izole etmeyi başardı.[8][9]
Elementin ilk kullanımı 1903'te, vanadyum alaşımlı çeliğin üretimiyle gerçekleşti.[9] İlk geniş çaplı endüstriyel kullanımı ise 1905'te, Ford Model T'nin alaşımlı çelik şasisinde oldu. Vanadyumun eklenmesiyle çeliğin kütlesi azalırken çekme dayanımı artmıştı.[10] 1911'de Martin Henze, Ascidiacea üyelerinin kan hücrelerinde (ya da sölom hücrelerinde), vanadyum içeren hemovanadin proteinlerini keşfetti.[11][12] 1927'de John Wesley Marden ile Malcolm N. Rich, vanadyum pentoksidin (V2O5) kalsiyum (Ca) ile indirgenmesi sonucunda %99,8 saflığında vanadyum elde etti.[13] İlerleyen dönemde uranyuma olan talebin artması, elde edilen vanadyumum da artmasına yol açtı. Karnotit (K2(UO2)2(VO4)2) kullanılarak uranyum elde edilirken vanadyum da yan ürün olarak ortaya çıkıyordu.[14]
Özellikleri
Fiziksel ve kimyasal özellikleri
Bir geçiş metali olan ve periyodik tablonun 5. grubunda yer alan vanadyumun mavi-gri renkli, metalik bir görünümü vardır. Sünek bir element olup oda sıcaklığında dövülebilir. Elektriği iletirken ısıyı yalıtır.[9][15][16]
Mohs ölçeğine göre 6,7 sertlik değerine sahip olan vanadyum,[17] Vickers testinde 628-640 MPa, Brinell testinde ise 600-742 MPa basınca dayanıklıdır. Vanadyumun mekanik özellikleri, elementik saflığına, dolayısıyla üretim yöntemine göre değişiklik gösterir. Oksijen, hidrojen, azot ve karbon; sertliği ve çekme dayanımını arttırırken sünekliği azaltır.[9] Korozyona karşı dirençli, alkaliler ile sülfürik ve hidroklorik asitlere karşı kararlıdır.[18] Sıcaklığı 250 °C (523 K; 482 °F) altındaki havada kararlıdır. Sürekli depolama, yüzeyinin kahverengimsi siyaha dönmesine neden olurken 300 °C (573 K; 572 °F) üstündeki havada kayda değer bir oksitlenme başlar. 500 °C (773 K; 932 °F) sıcaklığa kadar olan ortamlarda, hidrojeni arayerlerinde depolayarak gevrekleşir ve toz hâline getirilmesi kolaylaşır. Elementin vakumlu bir ortama alınıp sıcaklığın 600-700 °C (873-973 K; 1112-1292 °F) değerlerine yükseltilmesiyle bu hidrojen serbest kalır. Düşük sıcaklıklarda V-H sisteminde bir hidrür fazı gözlemlenir.[9]
Elementin erime noktası 1.910 °C (3.470 °F; 2.180 K) ile 1.935 °C (3.515 °F; 2.208 K) arasında, kaynama noktası ise 3.407 °C (6.165 °F; 3.680 K) kadardır.[19][9] Katı hâldeki yoğunluğu 6,0-6,11 g/cm3 arasındayken sıvı hâldeki yoğunluğu 5,5 g/cm3 kadardır.[20][21][22] Paramanyetik olan vanadyum,[23] kafes sabitinin 0,3 nm olduğu hacim merkezli kübik kristal yapıya sahiptir.[9][24] Elektronegatifliği, Pauling ölçeğine göre 1,63'tür.[25]
İzotopları
Doğada bulunan vanadyumun %99,75'i kararlı bir izotop olan vanadyum-51, kalan %0,25'i ise bir radyoizotop olan vanadyum-50 şeklindedir. Vanadyum-51 izotopunun çekirdek spini 7⁄2'dir. Vanadyum-50, 2,71 × 1017 yıllık yarı ömre sahiptir ve sonrasında ya elektron yakalanması (%83) geçirerek titanyum-50 ya da beta bozunması (%17) geçirerek krom-50 oluşturur.[26]
Elementin, kütle numarası 40 ilâ 65 arasında değişen 24 yapay radyoizotopu tespit edilmiştir. 330 günlük yarı ömre sahip vanadyum-49, elementin en kararlı yapay radyoizotopudur. Vanadyum-48'in 16 günlük yarı ömrü varken kalan izotopların yarı ömürleri bir saatten kısadır. En az dört izotopunun yarı kararlı uyarılmış durumları vardır.[26] Vanadyum-49'dan, elektron yakalanması geçiren vanadyum-48 ile izometrik geçiş sonucu vanadyum-46 oluşturan vanadyum-46m hariç, vanadyum-43'e kadar tüm izotoplar beta bozunmasına uğrar. Kütle numarası 40'tan düşük vanadyum izotoplarının bozunma türü proton emisyonu, 51'den büyük olanlarınki ise beta eksi bozunmasıdır. %0,1 oranında kalsiyum-40 oluşturan vanadyum-44 dışında, 50'den düşük kütle numarasına sahip izotoplar titanyum, 51'den yüksek kütle numarasına sahip izotoplar ise krom izotoplarına bozunur.[27]
Bileşikleri

Vanadyum, komplekslerinde -3, -1, 0, +1, +2, +3, +4 ve +5 yükseltgenme durumlarına sahip olabilir. En yaygın bulunduğu yükseltgenme durumları +2 ile +5 arasındakilerdir ve sulu çözeltide bu durumlar, pH değerine göre sırasıyla [V(H2O)6]2+ formülüyle lila, [V(H2O)6]3+ formülüyle yeşil, [VO(H2O)5]2+ formülüyle mavi ya da [VO(H2O)5]3+ formülüyle sarı-turuncu birer su kompleksi oluşturur. Doğada ise vanadyum, +3 ile +5 arasındaki yükseltgenme durumlarında bulunur.[18][28]
Vanadyum(II) bileşikleri indirgen, vanadyum(V) bileşikleri ise yükseltgendir. Vanadyum(IV) bileşikleri genellikle, merkezinde VO2+ bulunan vanadil türevleri şeklindedir. Amonyum vanadat(V) (NH4VO3), çinko (Zn) ile indirgenilerek vanadyumun +2 ile +5 arasındaki yükseltgenme durumlarındaki farklı renkleri almasını sağlayabilir. Daha düşük yükseltgenme durumları, V(CO)6, [V(CO)6]- ya da benzer bileşiklerde görülür.[18]
Vanadyum redoks pilinin bir elektrodu vanadyumun +5/+4 yükseltgenme durumu çiftini, diğer elektrodu ise +3/+2 çiftini kullanır. Bu yükseltgenme durumları arasındaki dönüşüm, çinko tozu ya da amalgam içeren bir vanadyum(V) bileşiğinin güçlü bir asidik çözeltisinin indirgenmesiyle gözlemlenir. Pervanadilin [VO2(H2O)4]+ neden olduğu başlangıçtaki sarı renk, sonrasında sırasıyla [VO(H2O)5]2+ bileşiğinin mavi, [V(H2O)6]3+ bileşiğinin yeşil ve [V(H2O)6]2+ bileşiğinin mor rengine dönüşür.[18]
Oksianyonlar

Sulu çözeltide vanadyum(V), pH ve yoğunluğa bağlı olan en az 11 tür oksianyon oluşturur.[30] Dört yüzlü ortovanadat iyonu VO3-4, pH değerinin 12-14 arasında olduğu çözeltilerdeki birincil türdür.[31] Daha düşük pH değerlerinde, monomer [HVO4]2- ile dimer [V2O7]4- barındıran çözeltiler ortaya çıkar. Vanadyum yoğunluğu yaklaşık 10−2M'den, toplam vanadyum yoğunluğunun logaritmasının M'ye oranının negatif değeri olan pV değerinin de 2'den düşük olduğu bu çözeltilerde [HVO4]2- baskındır.[32][33] pH değeri düştükçe, protonlanma ve yoğunlaşma artarak polivanadatlar oluşturur. 4-6 pH değeri aralığında [H2VO4]- baskın ve pV değerinin yaklaşık 4 fazla olduğu daha yoğun çözeltilerde trimer ve tetramerler oluşur.[34] 2-4 arasındaki pH değerinde, ortovanadatın aşağıdaki yoğunlaşma reaksiyonu sonucu oluşturduğu dekavanadat [V10O28]6- baskın hâle gelir:
- 10 [VO4]3- + 24 H+ → [V10O28]6- + 12 H2O
Dekavanadattaki her V(V) merkezi, altışar oksit ligand çevreler.[18] Vanadik asit H3VO4, dört yüzlü [H2VO4]- türlerinin protonlanması sonucunda öncelikli olarak sekiz yüzlü [VO2(H2O)4]+ türünün oluşmasından ötürü yalnızca çok düşük yoğunluklarda var olur.[35] 2'den düşük pH değerine sahip asidik çözeltilerde baskın olan tür dioksovanadyum monokatyon [VO2(H2O)4]+ iken; yüksek yoğunluklarda vanadik asidin asit anhidratı olan vanadyum pentoksit V2O5 çökelir.[36]
Vanadyum(V), bromoperoksidaz enzimlerinin vanadyum içeren etkin alanındakiler gibi çeşitli peroksit kompleksleri oluşturur. VO(O2)(H2O)4+ türü, asidik çözeltilerde kararlıdır. Alkali çözeltilerde ise 2, 3 ya da 4 peroksit gruplu türler bilinir. 4 peroksit gruplular; M3V(O2)4 nH2O (M ile gösterilen kısım Li, Na vs olabilir) formüllü, mor renkli ve vanadyumun 8 koordinatlı on iki yüzlü yapıda olduğu tuzlar oluşturur.[37][38]
Halojenür türevleri
Vanadyumun bilinen, VXn (n=2..5) formüllü on iki çift halojenürü mevcuttur.[39] Vanadyum tetraiyodür VI4, vanadyum pentaklorür VCl5, vanadyum bromür VBr5 ve vanadyum pentaiyodürün VI5 varlığı tespit edilememiş olup var olmaları durumundaysa son derece kararsızdır. Diğer reaktiflerle birlikte vanadyum tetraklorür VCl4, dienlerin polimerizasyonunda katalizör olarak kullanılır. Tüm çift halojenürler gibi vanadyum halojenürler de Lewis asididir.[39] Vanadyum halojenürlerin çoğu, VXnL6-n (X=halojenür, L=diğer ligant) formülüyle sekiz yüzlü yapılar meydana getirir.
VOmXn formüllü birçok vanadyum oksihalojenür vardır.[40] Uçucu olan vanadyum oksitriklorür VOCl3 ile vanadyum(V) oksitriflorür VOF3,[41] gaz hâlindeyken dört yüzlü ve Lewis asididir.[42]
Koordinasyon bileşikleri

Vanadyum(II) ve (III) bileşikleri indirgen, V(IV) ve V(V) bileşikleri ise yükseltgendir. Vanadyum iyonunun bazı bileşikleri, [V(CN)7]4- örneğindeki gibi 6'dan yüksek koordinasyon sayısına ulaşırlar. Oksovanadyum(V), yükseltgen bromlaşma ve tiyoeter yükseltgenmelerinde kullanılan tetradentat ligandlar ve peroksitlerle birlikte 7 koordinatlı koordinasyon bileşikleri oluştururlar. V4+'ün koordinasyon kimyasında, kendisine güçlü bağlanan dört ligand ile zayıf bağlanan bir ligand olan VO2+ merkezi baskındır. Bu duruma bir örnek teşkil eden vanadil asetilasetonat V(O)(O2C5H72) bileşiğinde vanadyum, 5 koordinatlı ve bozuk bir kare piramit şeklinde olduğundan, piridin gibi altıncı bir ligand bağlanabilse de bu sürecin bağlanma sabiti düşük olur. VOCl2(NMe3)2 gibi 5 koordinatlı vanadil bileşiklerinin çoğu trigonal bipiramidal yapıdadır.[43] V5+'in koordinasyon kimyasında; genellikle vanadyum(IV) öncüllerinin hava oksitlenmesi sonucu oluşan, +5 yükseltgenme durumunun kararlı hâle gelmesini ve +4 ile +5 yükseltgenme durumları arasındaki dönüşümün kolaylaşmasını sağlayan görece kararlı dioksovanadyum koordinasyon bileşikleri baskındır.[44][45]
Organometalik bileşikler
Vanadyumun organometalik bileşiklerinden olan vanadosen diklorür, uçucu bir başlatıcı reaktiftir.[46] Vanadyum hekzakarbonil V(CO)6, paramanyetik bir metal karbonildir.[47][48]
Doğadaki varlığı ve eldesi

Tahminî 120 mg/kg'lik oranıyla Yerkabuğu'nun yaklaşık %0,012'sini oluşturan vanadyum, Yerkabuğu'nda en bol bulunan 20. elementtir.[49] 20. yüzyılın başlarında; Junín, Cerro de Pasco, Peru yakınlarındaki Ragra Madeni'nde bir vanadyum cevheri keşfedildi.[50][51][52] Bu dönemlerde patronit (VS4), vanadyum elde ediliminde kullanılan başlıca mineraldi.[53] 1920 itibarıyla, dünyadaki vanadyum üretiminin yaklaşık üçte ikisi bu madende gerçekleştiriliyordu.[54] 1910 ve 1920'lerde karnotitten (K2(UO2)2(VO4)2·3H2O) uranyum üretimi başlayınca, vanadyum da bu süreçte ortaya çıkan bir ara ürün olarak elde edilmeye; vanadinit ve diğer vanadyum içeren mineraller de yalnızca istisnai durumlarda çıkarılmaya başlandı. Elemente olan talebin artmasıyla, günümüzde dünyadaki vanadyum üretiminin çoğu, ultramafik gabro yığınlarındaki vanadyum barındıran manyetitten elde edilir. Manyetit demir üretiminde kullanılırsa, vanadyumun çoğu cürufa gider ve buradan ayrıştırılır.[52][55]
2022 verilerine göre dünyada çıkarılan 100.000 ton vanadyumun %96'sı Çin, Güney Afrika Cumhuriyeti ve Rusya'da elde edilirken Çin'in dünyadaki payı %70'tir.[56]
Boksitin yanı sıra ham petrol, kömür, petrollü şeyl ve petrol kumu yataklarında da vanadyum bulunur. Ham petrolde, 1200 ppm'e kadar ulaşan vanadyum yoğunluğu kaydedilmiştir. Bu petrol ürünleri yakıldığında ortaya çıkan eser miktardaki vanadyum, motor ve kazanlarda korozyona neden olabilir.[57] Yılda 110.000 ton vanadyumun, fosil yakıtların yakılması sonucunda atmosfere karıştığı tahmin edilir.[58] Siyah şeyller de potansiyel vanadyum kaynağıdır. II. Dünya Savaşı sırasında İsveç'in güneyindeki alum şeylerinden vanadyum elde edilmiştir.[59]
Evrende vanadyumun bolluğu %0,0001 kadardır.[60] Spektrometrik olarak element, Güneş'in yanı sıra diğer bazı yıldızların yaydığı ışıkta tespit edilir.[61] Deniz suyunda, ortalama 30 nM (1,5 mg/m3) kadar vanadil bulunur.[60] Bazı maden suyu kaynakları da vanadil içerir. Örneğin Fuji Dağı civarındaki kaynakların 54 μg/L'ye kadar vanadil içerdiği tespit edilmiştir.[60]
Üretimi


Vanadyum elde etmek için ilk olarak ezilmiş cehver, sodyum klorür (NaCl) ya da sodyum karbonat (Na2CO3) ile yaklaşık 850 °C'de reaksiyona sokularak sodyum metavanadat (NaVO3) elde edilir. Suda çözdürülen bu katının asitlendirilmesiyle elde edilen kırmızı renkli polivanadat tuzu (V2O5) çökeltisi, kalsiyum (Ca) ile indirgenerek saf vanadyum ortaya çıkar. Vanadyum pentoksitin (V2O5) hidrojen (H) ya da magnezyum (Mg) ile indirgenmesi, daha az miktarda ürün elde edilmesi için kullanılan bir yöntemdir. Bununla birlikte, başka bir ürün elde etme amacıyla kullanılan ve vanadyumun bir yan ürün olarak sentezlendiği çeşitli işlemler de mevcuttur.[62] Element, van Arkel-de Boer işlemine göre, bir metal iyodür olan vanadyum(III) iyodürün sentezlenmesinin ardından buradan ayrıştırılarak saflaştırılabilir:[63]
- 2 V + 3 I2
 2 VI3
2 VI3
Alaşımlı çelikte kullanılan ferrovanadyum; vanadyum oksit, demir oksitler ve demir karışımıın bir elektrik fırınında indirgenmesiyle elde edilir. Vanadyum barındıran magnetitten elde edilen pik demirde vanadyum da bulunur. Kullanılan cevhere göre, cürufta %25'e kadar vanadyum bulunur.[62]
Kullanım alanları

Alaşımlar
Üretilen vanadyumun yaklaşık %85'i, ferrovanadyum ya da alaşımlı çelikte kullanılır.[62] Kararlı nitrür ve karbürler oluşturan vanadyum, çeliğin dayanımını arttırır.[64] Vanadyumlu çelik; akslar, bisiklet gövdeleri, krank milleri, dişli çark ve diğer elemanlarda kullanılır. Vanadyum içeren yüksek karbonlu çelik alaşımları %0,15-0,25 oranında, yüksek hızlı alet çeliği ise %1-5 oranında vanadyum içerir. Yüksek hızlı alet çeliklerinde, 60'ın üzerine Rockwell sertliğine erişilebilir. Bu tür çelikler, cerrahi aletler ile aletlerde kullanılır.[65] %18'e kadar vanadyum içeren toz metalurjisi alaşımları, alet ve bıçaklarda kullanılır.[66]
Vanadyum, beta titanyumun dayanımını ile ısıya karşı kararlılığını arttırır. Alüminyum ile vanadyumun eklendiği titanyum alaşımları; jet motorları, yüksek hızlı hava taşıtı gövdeleri ve diş implantlarında kullanılır. Kaynaksız borularda en yaygın kullanılan alaşım olan titanyum 3/2,5, %2,5 oranında vanadyum içerir ve bu alaşım aynı zamanda havacılık, savunma ve bisiklet endüstrilerinde de kullanılır. Titantum 6AL-4V alaşımı ise %4 oranında vanadyum içerir.[67] 40 ilâ 270 ppm kadar vanadyum eklendiğinde Wootz çeliğinin dayanımı artar ve çeliğe farklı bir desen verir.[68]
Bazı vanadyum alaşımları süperiletken davranış gösterir. İlk A15 fazı süperiletken, 1952'de keşfedilen vanadyum silisürdü (V3Si).[69] Süperiletken mıknatıslarda (17,5 tesla ya da 175.000 gauss) vanadyum-galyum şeritler kullanılır.[70]
Zırh imalatında kullanılan çelikteki molibden, vanadyumla değiştirilebilir. Bu durumda daha gevrek ve delici olmayan darbelerde parçalanmaya daha eğimli bir alaşım elde edilir.[71] Bu tür alaşımlarla yapılan zırhlar, Tiger II ya da Jagdtiger gibi Nazi Almanyası yapımı tanklarda kullanılmıştı.[72]
Katalizör olarak

Vanadyum pentoksit (V2O5), sülfürik asit üretimi esnasındaki temas sürecinde bir katalizör olarak kullanılır.[73][74] Bu süreçte kükürt dioksit (SO2) kükürt triokside (SO3) yükseltgenirken vanadyum +5'ten +4'e indirgenir:[18]
- V2O5 + SO2 → 2 VO2 + SO3
Katalizör, oksijenle yükseltgenerek yeniden oluşur:
- 4 VO2 + O2 → 2 V2O5
Benzer yükseltgenmeler, maleik anhidrür oluşumunda da kullanılır:
- C4H10 + 3,5 O2 → C4H2O3 + 4 H2O
Ftalik anhidrür ve birtakım organik bileşikler de benzer şekilde meydana gelir. Bu yeşil kimya süreçleri, ucuz hammaddeleri, işlevsel ve çok amaçlı ara ürünlere dönüştürür.[9][75]
Vanadyum ayrıca; propanın akroleine ve propilenin akrilik asite yükseltilmesinde ya da propilenin akrilonitrile amoksidasyonunda kullanılan karışık metal oksit katalizörlerinin bir parçasıdır.[76]
Organovanadyum bileşikleri, bütadien bazlı sentetik kauçuk üretiminde katalizör olarak kullanılır.[77][78]
Diğer kullanım alanları
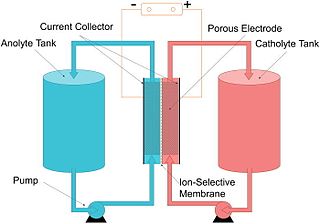
Farklı yükseltgenme durumlarındaki sulu vanadyum iyonlarını bulunduran elektrokimyasal hücrelerden meydana gelen bir tür akış pili olan vanadyum redoks piline dair ilk fikirler 1930'larda ortaya atılsa da üretimi 1980'lerde gerçekleştirildi.[79][80] Bu tür piller, şebeke enerjisi depolamada kullanılır.[81]
Vanadat, dönüşüm kaplaması yöntemiyle çeliklerin paslanma ve korozyona karşı korunmasında kullanılır.[82] Vanadyum folyo, hem demir hem de titanyumla uyumlu olduğundan, titanyumun çeliğe giydirilmesinde kullanılır.[83] Uygun ısıl nötron yakalanması kesiti ve nötron yakalanmasıyla meydana gelen izotoplarının kısa yarı önründen ötürü element, füzyon reaktörlerinin iç yapısı için uygun bir malzemedir.[84][85] Vanadyum, lityum demir fosfat pillerin katotlarına %5'ten düşük bir oranda eklenerek iyonik iletkenliği arttırabilir.[86]
Lityum vanadyum oksidin, lityum iyon pillerin yüksek enerji yoğunluklu anotu olarak kullanılabileceği fikri ortaya atılmıştır.[87] Vanadyum fosfatın ise gelecekte, başka bir tür lityum iyon pil türü olan lityum vanadyum fosfat pilin katodu olarak kullanılabileceği belirtilir.[88]
Biyolojik rolleri
Bazı deniz su yosunu türleri; vanadyum bromoperoksidaz, kloroperoksidaz (bir hem ya da vanadyum kofaktörü olarak kullanılabilir) ve iyodoperoksidaz sentezler. Bromoperoksidaz, her yıl yaklaşık 1-2 milyon ton bromoform ile 56.000 ton bromometan üretir.[89] Doğada en çok bulunan organobromür bileşiğini üreten bu enzim, aşağıdaki reaksiyonda katalizör görevi görür (R-H hidrokarbon substratıdır):[90]
Vanadyum nitrojenaz, bazı azot bağlayıcı mikroorganizmalar tarafından kullanılır. Daha yaygın olan molibden ya da demir yerine kullanılan vanadyum, nitrojenaza daha farklı özellikler verir.[91]
Tulumlular için zorunlu olan vanadyum, vanadositlerdeki yüksek asitli kofullarda depolanır. Bu hücrelerin sitoplazmalarında vanabinler bulunur. Ascidiacea sınıfına mensup tulumluların kanındaki vanadyum yoğunluğu, 1 ilâ 2 µg/L kadar vanadyum yoğunluğuna sahip kendisini çevreleyen deniz suyundan on milyon kadar fazladır.[92][93][94][95] Bu yoğun vanadyumlu sistem ile vanadyum barındıran proteinlerin işlevi bilinmemekle birlikte, vanadositler daha sonraları bu canlıların tulumlarının dış yüzeyinin altında depolanır ve bu sayede avcılara karşı caydırıcı bir etkisinin olabileceği düşünülür.[96]
Amanita muscaria ve bağlantılı mantar türleri, kuru kütleleri için 500 mg/kg'ye kadar vanadyum depolar. Element, mantarların gövdelerindeki amavadin kompleksinde bulunur.[97] Bu depolamanın biyolojik önemi bilinmemekle birlikte,[98][99] toksik ya da peroksidaz işlevleri olabileceği öne sürülmüştür.[100]
Fareler üzerinde yapılan deneylerde vanadyum eksikliğinin, hayvanların büyümelerinde azalmaya yol açtığı görüldü.[101] Ulusal Tıp Enstitüsü, vanadyumun insanlar için zorunlu, tavsiye edilen ya da uygun bir gıda olduğunu belirtmez. Günlük yaklaşık 6 ilâ 18 µg tüketildiği tahmin edilen vanadyumun %5'ten azı sindirilir. Elementin günlük 1,8 mg'den fazla tüketilmesi durumunda olumsuz etkiler görülebileceği kaydedilir.[102]
Tehlikeleri
Vanadyum bileşiklerinin tamamı toksik sayılmalıdır.[103] Dört değerlikli vanadil sülfat (VOSO4), üç değerlikli vanadyum(III) oksitten (V2O3) en az 5 kat daha toksiktir.[104] İş Güvenliği ve Sağlığı İdaresi (OSHA); günde 8 ilâ 10, haftada ise 40 saat çalışan iş yerleri için, havadaki vanadyum pentoksit tozu miktarının en fazla 0,05 mg/m3, vanadyum pentoksit dumanı miktarının ise en fazla 0,1 mg/m3 olabileceğini belirtir.[105] Ulusal İş Güvenliği ve Sağlığı Enstitüsü (NIOSH), 35 mg/m3 vanadyumun acil sağlık ve yaşam tehlikesi sayılması gerektiğini ifade ederek kalıcı sağlık sorunları ya da ölüme yol açabileceği konusunda uyarıda bulunur.[105]
Vanadyum bileşiklerinin gastrointestinal sistemde emilmesi görece düşüktür. Vanadyum ile bileşiklerinin solunması, solunum sisteminde birtakım olumsuzluklara yol açabilir.[106][107][108] Fareler üzerinde yapılan deneylerde ağızdan alınma ya da soluma sonucunda kan değerleri,[109][110] karaciğer,[111] sinirsel gelişim[112] ve diğer organlardaki[113] birtakım olumsuzluklar tespit edilmiştir.
Vanadyum veya vanadyum bileşiklerinin üreme toksini ya da teratojen olduğuna dair birtakım kanıtlar vardır. Vanadyum pentoksidin solunduğunda erkek ve dişi farelerde kanserojen etki yaptığı kaydedilse de,[107] birkaç yıl sonra gerçekleştirilen başka bir çalışmada bu bulguların doğruluğu sorgulanmıştır.[114] Vanadyumun kanserojenliği için Birleşik Devletler Çevre Koruma Ajansının belirlediği bir değer yoktur.[115]
Mazottaki eser miktardaki vanadyum, yüksek sıcaklık korozyonunun temel yakıt bileşenidir. Yanma sırasında yükseltgenen vanadyum, vanadyum oksit hâline gelerek sodyum ve kükürtle reaksiyona girer. Ortaya çıkan erime noktaları 530 °C (986 °F) kadar olan vanadat bileşikleri, çeliğin pasifleştirme katmanını korozyona elverişli duruma getirir. Katı vanadyum bileşikleri, aynı zamanda motor bileşenlerini aşındırır.[116][117]
Kaynakça
- Özel
- ^ a b c d e f g Caswell, Lyman R. "Andrés del Río, Alexander von Humboldt and the twice-discovered element" (PDF). Bulletin for the History of Chemistry (İngilizce). 28 (1): 35-41. 22 Kasım 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 18 Aralık 2023.
- ^ del Río, Andrés Manuel (1804). "Discurso de las Vetas". Anales de Ciencias Naturales (İspanyolca). 7: 30-48.
- ^ Collet-Descotils, Hippolyte-Victor (1805). "Analyse de la mine brune de plomb de Zimapan, dans le royaume du Mexique, envoyée par M. Humboldt, et dans laquelle M. Del Rio dit avoir découvert un nouveau métal."". Annales de chimie (Fransızca). 53: 268-271.
- ^ Sefström, Nils Gabriel (1831). "Ueber das Vanadin, ein neues Metall, gefunden im Stangeneisen von Eckersholm, einer Eisenhütte, die ihr Erz von Taberg in Småland bezieht". Annalen der Physik und Chemie (Almanca). 97 (1): 43-49. Bibcode:1831AnP....97...43S. doi:10.1002/andp.18310970103. 10 Eylül 2021 tarihinde kaynağından arşivlendi.
- ^ a b Hoppe, Günter; Siemroth, Jürgen; Damaschun, Ferdinand. "Alexander von Humboldt und die Entdeckung des Vanadiums". Chemie der Erde (Almanca). 50: 81-94.
- ^ Featherstonhaugh, George William (1831). "New Metal, provisionally called Vanadium". The Monthly American Journal of Geology and Natural Science (İngilizce): 67-69.
- ^ Habashi, Fathi (Ocak 2001). "Historical Introduction to Refractory Metals". Mineral Processing and Extractive Metallurgy Review (İngilizce). 22 (1): 25-53. Bibcode:2001MPEMR..22...25H. doi:10.1080/08827509808962488.
- ^ Roscoe, Henry Enfield (31 Ocak 1870). "XIX. Researches on vanadium". Proceedings of the Royal Society of London (İngilizce). 18 (114-122): 37-42. doi:10.1098/rspl.1869.0012.
- ^ a b c d e f g h Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_367.pub2.
- ^ Betz, Frederick (2003). Managing Technological Innovation: Competitive Advantage from Change (İngilizce). Wiley. ss. 158-159. ISBN 978-0-471-22563-8.
- ^ Henze, Martin (1911). "Untersuchungen über das Blut der Ascidien. I. Mitteilung". Hoppe-Seyler's Zeitschrift für Physiologische Chemie (İngilizce). 72 (5-6): 494-50. doi:10.1515/bchm2.1911.72.5-6.494.
- ^ Michibata, H.; Uyama, T.; Ueki, T.; Kanamori, K. (2002). "Vanadocytes, cells hold the key to resolving the highly selective accumulation and reduction of vanadium in ascidians". Microscopy Research and Technique (İngilizce). 56 (6): 421-434. doi:10.1002/jemt.10042. PMID 11921344.
- ^ Marden, John Wesley; Rich, Malcolm N. (Temmuz 1927). "Vanadium 1". Industrial & Engineering Chemistry (İngilizce). 19 (7): 786-788. doi:10.1021/ie50211a012.
- ^ Busch, Phillip Maxwell (1961). Vanadium: A Materials Survey (İngilizce). Amerika Birleşik Devletleri İçişleri Bakanlığı Madenler Bürosu. s. 65. OCLC 934517147. 23 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2023.
- ^ Vander Voort, George F. (1984). Metallography, Principles and Practice (İngilizce). ASM International. s. 137. ISBN 978-0-87170-672-0.
- ^ Cardarelli, François (2008). Materials Handbook (İngilizce). Springer. s. 338. ISBN 978-1-84628-668-1.
- ^ Sun, Shuai; Deng, Nana; Zhang, Hongbin; He, Lianfang; Zhou, Haiping; Han, Baokun; Gao, Kuidong; Wang, Xin (Kasım-Aralık 2021). "Microstructure and mechanical properties of AZ31 magnesium alloy reinforced with novel sub-micron vanadium particles by powder metallurgy". Journal of Materials Research and Technology (İngilizce). 15: 1789-1800. doi:10.1016/j.jmrt.2021.09.015.
- ^ a b c d e f Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Vanadium". Lehrbuch der Anorganischen Chemie (Almanca) (91-100 bas.). Walter de Gruyter. ss. 1071-1075. ISBN 978-3-11-007511-3.
- ^ Haynes 2017, s. 4-93, 4-118.
- ^ Haynes 2017, s. 4-125.
- ^ Paradis, Paul-François; Ishikawa, Takehiko; Aoyama, Tomotsugu; Yoda, Shinichi (Aralık 2002). "Thermophysical properties of vanadium at high temperature measured with an electrostatic levitation furnace". The Journal of Chemical Thermodynamics (İngilizce). 34 (12): 1929-1942. doi:10.1016/S0021-9614(02)00126-X.
- ^ Speight, James G., (Ed.) (2005). "Physical Constants of Inorganic Compounds". Lange's Handbook of Chemistry (İngilizce) (16. bas.). McGraw-Hill. s. 1.61. ISBN 0-07-143220-5.
- ^ Krzystek, Jurek; Ozarowski, Andrew; Telser, Joshua; Crans, Debbie C. (15 Ekim 2015). "High-frequency and -field electron paramagnetic resonance of vanadium(IV, III, and II) complexes". Coordination Chemistry Reviews (İngilizce). 301-302: 123-133. doi:10.1016/j.ccr.2014.10.014.
- ^ Del Carpio, Edgar; Hernández, Lino; Ciangherotti, Carlos; Villalobos Coa, Valentina; Jiménez, Lissette; Lubes, Vito; Lubes, Giuseppe (1 Ekim 2018). "Vanadium: History, chemistry, interactions with a-amino acids and potential therapeutic applications". Coordination Chemistry Reviews (İngilizce). Elsevier. 372: 117-140. doi:10.1016/j.ccr.2018.06.002.
- ^ Majjane, Abdelilah; Chahine, Abdelkrim; Et-tabirou, Mohamed; Echchahed, Bousselham; Do, Trong-On; McBreen, Peter (15 Ocak 2014). "X-ray photoelectron spectroscopy (XPS) and FTIR studies of vanadium barium phosphate glasses". Materials Chemistry and Physics (İngilizce). Elsevier. 143 (2): 779-787. doi:10.1016/j.matchemphys.2013.10.013.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003). "The NUBASE evaluation of nuclear and decay properties". Nuclear Physics A (İngilizce). 729: 3-128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties". Chinese Physics C (İngilizce). 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Butler, Alison (1990). "The Coordination and Redox Chemistry of Vanadium in Aqueous Solution". Chasteen, N. Dennis (Ed.). Vanadium in Biological Systems (İngilizce). Dordrecht: Springer. ss. 25-49. doi:10.1007/978-94-009-2023-1_2. ISBN 978-94-010-7407-0.
- ^ Al-Kharafi, F. M.; Badawy, W. A. (1997). "Electrochemical behavior of vanadium in aqueous solutions of different pH". Electrochimica Acta (İngilizce). 42 (4): 579-586. doi:10.1016/S0013-4686(96)00202-2.
- ^ Greenwood & Earnshaw 1997, s. 984.
- ^ Greenwood & Earnshaw 1997, s. 988.
- ^ Crans, Debbie C. (18 Aralık 2015). "Antidiabetic, Chemical, and Physical Properties of Organic Vanadates as Presumed Transition-State Inhibitors for Phosphatases". The Journal of Organic Chemistry (İngilizce). 80 (24): 11899-11915. doi:10.1021/acs.joc.5b02229. PMID 26544762.
- ^ Jung, Sabrina (2018). Speciation of molybdenum- and vanadium-based polyoxometalate species in aqueous medium and gas-phase and its consequences for M1 structured MoV oxide synthesis (Tez) (İngilizce). doi:10.14279/depositonce-7254.
- ^ Cruywagen, J. J. (1999), Sykes, A. G. (Ed.), Protonation, Oligomerization, and Condensation Reactions of Vanadate(V), Molybdate(vi), and Tungstate(vi), Advances in Inorganic Chemistry (İngilizce), 49, Academic Press, ss. 127-182, doi:10.1016/S0898-8838(08)60270-6, ISBN 978-0-12-023649-7
- ^ Tracey, Alan S.; Willsky, Gail R.; Takeuchi, Esther S. (19 Mart 2007). Vanadium: Chemistry, Biochemistry, Pharmacology and Practical Applications (İngilizce). CRC Press. ISBN 978-1-4200-4614-4.
- ^ Dieter 2008, s. 13.
- ^ Greenwood & Earnshaw 1997, s. 994.
- ^ Strukul, Giorgio (1992). Catalytic Oxidations with Hydrogen Peroxide as Oxidant (İngilizce). Springer. s. 128. ISBN 978-0-7923-1771-5.
- ^ a b Greenwood & Earnshaw 1997, s. 989.
- ^ Greenwood & Earnshaw 1997, s. 993.
- ^ Flesch, Gerald D.; Svec, Harry J. (1 Ağustos 1975). "Thermochemistry of vanadium oxytrichloride and vanadium oxytrifluoride by mass spectrometry". Inorganic Chemistry (İngilizce). 14 (8): 1817-1822. doi:10.1021/ic50150a015.
- ^ Iqbal, Javed; Bhatia, Beena; Nayyar, Naresh K. (Mart 1994). "Transition Metal-Promoted Free-Radical Reactions in Organic Synthesis: The Formation of Carbon-Carbon Bonds". Chemical Reviews (İngilizce). 94 (2): 519-564. doi:10.1021/cr00026a008.
- ^ Greenwood & Earnshaw 1997, s. 995.
- ^ Geiser, Jan Nicholas (2019). Development of an improved state-of-charge sensor for the all-vanadium redox flow battery (Tez) (İngilizce). doi:10.22028/D291-29229.
- ^ Nica, Simona; Rudolph, Manfred; Görls, Helmar; Plass, Winfried (Nisan 2007). "Structural characterization and electrochemical behavior of oxovanadium(V) complexes with N-salicylidene hydrazides". Inorganica Chimica Acta (İngilizce). 360 (5): 1743-1752. doi:10.1016/j.ica.2006.09.018.
- ^ Wilkinson, G.; Birmingham, J. M. (Eylül 1954). "Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta". Journal of the American Chemical Society (İngilizce). 76 (17): 4281-4284. doi:10.1021/ja01646a008.
- ^ Bellard, S.; Rubinson, K. A.; Sheldrick, G. M. (15 Şubat 1979). "Crystal and molecular structure of vanadium hexacarbonyl". Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry (İngilizce). 35 (2): 271-274. doi:10.1107/S0567740879003332.
- ^ Elschenbroich, C.; Salzer A. (1992). Organometallics: A Concise Introduction (İngilizce). Wiley-VCH. ISBN 978-3-527-28165-7.
- ^ Haynes 2017, s. 14-17.
- ^ Hillebrand, W. F. (1907). "The Vanadium Sulphide, Patronite, and ITS Mineral Associates from Minasragra, Peru". Journal of the American Chemical Society (İngilizce). 29 (7): 1019-1029. doi:10.1021/ja01961a006. 11 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Eylül 2020.
- ^ Hewett, F. (1906). "A New Occurrence of Vanadium in Peru". The Engineering and Mining Journal. 82 (9): 385.
- ^ a b Steinberg, W.S.; Geyser, W.; Nell, J. (2011). "The history and development of the pyrometallurgical processes at Evraz Highveld Steel & Vanadium" (PDF). The Journal of the Southern African Institute of Mining and Metallurgy. 111: 705-710. 11 Eylül 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 17 Aralık 2018.
- ^ "mineralogical data about Patrónite". mindata.org. 30 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ocak 2009.
- ^ Allen, M. A.; Butler, G. M. (1921). "Vanadium" (PDF). University of Arizona. 27 Nisan 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 20 Ocak 2020.
- ^ Hukkanen, E.; Walden, H. (1985). "The production of vanadium and steel from titanomagnetites". International Journal of Mineral Processing (İngilizce). 15 (1-2): 89-102. Bibcode:1985IJMP...15...89H. doi:10.1016/0301-7516(85)90026-2.
- ^ Polyak, Désirée E. "Mineral Commodity Summaries 2023: Vanadium" (PDF) (İngilizce). United States Geological Survey. 7 Şubat 2023 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 7 Şubat 2023.
- ^ Pearson, C. D.; Green, J. B. (1 Mayıs 1993). "Vanadium and nickel complexes in petroleum resid acid, base, and neutral fractions". Energy & Fuels (İngilizce). 7 (3): 338-346. doi:10.1021/ef00039a001. 11 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ağustos 2018.
- ^ Anke, Manfred (2004). "Vanadium: An element both essential and toxic to plants, animals and humans?" (PDF). Anales de la Real Academia Nacional de Farmacia (İngilizce). 70 (4): 961-999. 19 Nisan 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 19 Nisan 2023.
- ^ Dyni, John R. (2006). "Geology and resources of some world oil-shale deposits". Scientific Investigations Report (İngilizce). s. 22. doi:10.3133/sir29955294.
- ^ a b c Dieter 2008, ss. 9-10.
- ^ Cowley, C. R.; Elste, G. H.; Urbanski, J. L. (Ekim 1978). "Vanadium abundances in early A stars". Publications of the Astronomical Society of the Pacific (İngilizce). 90: 536. Bibcode:1978PASP...90..536C. doi:10.1086/130379.
- ^ a b c Moskalyk, R.R; Alfantazi, A.M (Eylül 2003). "Processing of vanadium: a review". Minerals Engineering (İngilizce). 16 (9): 793-805. Bibcode:2003MiEng..16..793M. doi:10.1016/S0892-6875(03)00213-9.
- ^ Carlson, O. N.; Owen, C. V. (1961). "Preparation of High-Purity Vanadium Metalb by the Iodide Refining Process". Journal of the Electrochemical Society (İngilizce). 108 (1): 88. doi:10.1149/1.2428019.
- ^ Chandler, Harry (1998). Metallurgy for the Non-metallurgist (İngilizce). ASM International. ss. 6-7. ISBN 978-0-87170-652-2.
- ^ Davis, Joseph R. (1995). Tool Materials: Tool Materials (İngilizce). ASM International. ISBN 978-0-87170-545-7.
- ^ Oleg D. Neikov; Naboychenko, Stanislav; Mourachova, Irina; Gopienko, Victor G.; Frishberg, Irina V.; Lotsko, Dina V. (24 Şubat 2009). Handbook of Non-Ferrous Metal Powders: Technologies and Applications (İngilizce). Elsevier. s. 490. ISBN 978-0-08-055940-7.
- ^ Zwicker, Ulrich (1974). "Herstellung des Metalls". Titan und Titanlegierungen (İngilizce). ss. 4-29. doi:10.1007/978-3-642-80587-5_2. ISBN 978-3-642-80588-2.
- ^ Verhoeven, J. D.; Pendray, A. H.; Dauksch, W. E. (Eylül 1998). "The key role of impurities in ancient damascus steel blades". JOM (İngilizce). 50 (9): 58-64. Bibcode:1998JOM....50i..58V. doi:10.1007/s11837-998-0419-y.
- ^ Hardy, George F.; Hulm, John K. (15 Şubat 1953). "Superconducting Silicides and Germanides". Physical Review (İngilizce). 89 (4): 884. Bibcode:1953PhRv...89Q.884H. doi:10.1103/PhysRev.89.884.
- ^ Markiewicz, W.; Mains, E.; Vankeuren, R.; Wilcox, R.; Rosner, C.; Inoue, H.; Hayashi, C.; Tachikawa, K. (Ocak 1977). "A 17.5 Tesla superconducting concentric Nb3Sn and V3Ga magnet system". IEEE Transactions on Magnetics (İngilizce). 13 (1): 35-37. doi:10.1109/TMAG.1977.1059431.
- ^ Rohrmann, B. (1985). "Vanadium in South Africa (Metal Review Series no. 2)". Journal of the Southern African Institute of Mining and Metallurgy (İngilizce). 85 (5): 141-150. hdl:10520/AJA0038223X_1959.
- ^ Overy, R. J. (1973). "Transportation and Rearmament in the Third Reich". The Historical Journal (İngilizce). 16 (2): 389-409. doi:10.1017/s0018246x00005926.
- ^ Langeslay, Ryan R.; Kaphan, David M.; Marshall, Christopher L.; Stair, Peter C.; Sattelberger, Alfred P.; Delferro, Massimiliano (8 Ekim 2018). "Catalytic Applications of Vanadium: A Mechanistic Perspective". Chemical Reviews (İngilizce). 119 (4): 2128-2191. doi:10.1021/acs.chemrev.8b00245. OSTI 1509906. PMID 30296048.
- ^ Eriksen, K.M.; Karydis, D.A.; Boghosian, S.; Fehrmann, R. (Ağustos 1995). "Deactivation and Compound Formation in Sulfuric-Acid Catalysts and Model Systems". Journal of Catalysis (İngilizce). 155 (1): 32-42. doi:10.1006/jcat.1995.1185.
- ^ Abon, Michel; Volta, Jean-Claude (Eylül 1997). "Vanadium phosphorus oxides for n-butane oxidation to maleic anhydride". Applied Catalysis A: General (İngilizce). 157 (1-2): 173-193. doi:10.1016/S0926-860X(97)00016-1.
- ^ Fierro, J. G. L., (Ed.) (2006). Metal Oxides, Chemistry and Applications (İngilizce). CRC Press. ss. 415-455. ISBN 978-0-8247-2371-2.
- ^ Nomura, Kotohiro; Zhang, Shu (2011). "Design of Vanadium Complex Catalysts for Precise Olefin Polymerization". Chemical Reviews (İngilizce). 111 (3): 2342-2362. doi:10.1021/cr100207h. PMID 21033737.
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.o23_o01.
- ^ Joerissen, Ludwig; Garche, Juergen; Fabjan, Ch.; Tomazic, G. (Mart 2004). "Possible use of vanadium redox-flow batteries for energy storage in small grids and stand-alone photovoltaic systems". Journal of Power Sources (İngilizce). 127 (1-2): 98-104. Bibcode:2004JPS...127...98J. doi:10.1016/j.jpowsour.2003.09.066.
- ^ Rychcik, M.; Skyllas-Kazacos, M. (Ocak 1988). "Characteristics of a new all-vanadium redox flow battery". Journal of Power Sources (İngilizce). 22 (1): 59-67. Bibcode:1988JPS....22...59R. doi:10.1016/0378-7753(88)80005-3.
- ^ Li, Liyu; Kim, Soowhan; Wang, Wei; Vijayakumar, M.; Nie, Zimin; Chen, Baowei; Zhang, Jianlu; Xia, Guanguang; Hu, Jianzhi; Graff, Gordon; Liu, Jun; Yang, Zhenguo (Mayıs 2011). "A Stable Vanadium Redox-Flow Battery with High Energy Density for Large-Scale Energy Storage". Advanced Energy Materials (İngilizce). 1 (3): 394-400. doi:10.1002/aenm.201100008.
- ^ Guan, H.; Buchheit, R. G. (1 Mart 2004). "Corrosion Protection of Aluminum Alloy 2024-T3 by Vanadate Conversion Coatings". Corrosion (İngilizce). 60 (3): 284-296. doi:10.5006/1.3287733.
- ^ Lositskii, N. T.; Grigor'ev, A. A.; Khitrova, G. V. (Aralık 1966). "Welding of chemical equipment made from two-layer sheet with titanium protective layer (review of foreign literature)". Chemical and Petroleum Engineering (İngilizce). 2 (12): 854-856. doi:10.1007/BF01146317.
- ^ Matsui, H.; Fukumoto, K.; Smith, D.L.; Chung, Hee M.; van Witzenburg, W.; Votinov, S. N. (Ekim 1996). "Status of vanadium alloys for fusion reactors". Journal of Nuclear Materials (İngilizce). 233-237: 92-99. Bibcode:1996JNuM..233...92M. doi:10.1016/S0022-3115(96)00331-5.
- ^ "Vanadium Data Sheet" (PDF) (İngilizce). ATI Wah Chang. 25 Şubat 2009 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 16 Ocak 2009.
- ^ US7842420B2, Wixom, Michael R. & Chuanjing Xu, "Electrode material with enhanced ionic transport properties", 30 Kasım 2010 tarihinde verildi 9 Temmuz 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Kariatsumari, Koji (Şubat 2008). "Li-Ion Rechargeable Batteries Made Safer" (İngilizce). Nikkei Business Publications. 12 Eylül 2011 tarihinde kaynağından arşivlendi.
- ^ Saïdi, M.Y.; Barker, J.; Huang, H.; Swoyer, J.L.; Adamson, G. (1 Haziran 2003). "Performance characteristics of lithium vanadium phosphate as a cathode material for lithium-ion batteries". Journal of Power Sources (İngilizce). 119-121: 266-272. Bibcode:2003JPS...119..266S. doi:10.1016/S0378-7753(03)00245-3.
- ^ Gribble, Gordon W. (1999). "The diversity of naturally occurring organobromine compounds". Chemical Society Reviews (İngilizce). 28 (5): 335-346. doi:10.1039/a900201d.
- ^ Butler, Alison; Carter-Franklin, Jayme N. (2004). "The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products". Natural Product Reports (İngilizce). 21 (1): 180-188. doi:10.1039/b302337k. PMID 15039842.
- ^ Robson, R. L.; Eady, R. R.; Richardson, T. H.; Miller, R. W.; Hawkins, M.; Postgate, J. R. (1986). "The alternative nitrogenase of Azotobacter chroococcum is a vanadium enzyme". Nature (İngilizce). 322 (6077): 388-390. Bibcode:1986Natur.322..388R. doi:10.1038/322388a0.
- ^ Smith, M. J. (1989). "Vanadium biochemistry: The unknown role of vanadium-containing cells in ascidians (sea squirts)". Experientia (İngilizce). 45 (5): 452-457. doi:10.1007/BF01952027. PMID 2656286.
- ^ MacAra, Ian G.; McLeod, G. C.; Kustin, Kenneth (1979). "Tunichromes and metal ion accumulation in tunicate blood cells". Comparative Biochemistry and Physiology B (İngilizce). 63 (3): 299-302. doi:10.1016/0305-0491(79)90252-9.
- ^ Trefry, John H.; Metz, Simone (1989). "Role of hydrothermal precipitates in the geochemical cycling of vanadium". Nature (İngilizce). 342 (6249): 531-533. Bibcode:1989Natur.342..531T. doi:10.1038/342531a0.
- ^ Weiss, H.; Guttman, M. A.; Korkisch, J.; Steffan, I. (1977). "Comparison of methods for the determination of vanadium in sea-water". Talanta (İngilizce). 24 (8): 509-511. doi:10.1016/0039-9140(77)80035-0. PMID 18962130.
- ^ Ruppert, Edward E.; Fox, Richard, S.; Barnes, Robert D. (2004). Invertebrate Zoology (İngilizce) (7. bas.). Cengage Learning. s. 947. ISBN 978-81-315-0104-7.
- ^ Kneifel, Helmut; Bayer, Ernst (Haziran 1973). "Determination of the Structure of the Vanadium Compound, Amavadine, from Fly Agaric". Angewandte Chemie International Edition in English (İngilizce). 12 (6): 508. doi:10.1002/anie.197305081.
- ^ Falandysz, J.; Kunito, T.; Kubota, R.; Lipka, K.; Mazur, A.; Falandysz, Justyna J.; Tanabe, S. (31 Ağustos 2007). "Selected elements in fly agaric Amanita muscaria". Journal of Environmental Science and Health, Part A (İngilizce). 42 (11): 1615-1623. doi:10.1080/10934520701517853. PMID 17849303.
- ^ Berry, Robert E.; Armstrong, Elaine M.; Beddoes, Roy L.; Collison, David; Ertok, S. Nigar; Helliwell, Madeleine; Garner, C. David (15 Mart 1999). "The Structural Characterization of Amavadin". Angewandte Chemie (İngilizce). 38 (6): 795-797. doi:10.1002/(SICI)1521-3773(19990315)38:6<795::AID-ANIE795>3.0.CO;2-7. PMID 29711812.
- ^ da Silva, José A. L.; Fraústo da Silva, João J. R.; Pombeiro, Armando J. L. (Ağustos 2013). "Amavadin, a vanadium natural complex: Its role and applications". Coordination Chemistry Reviews (İngilizce). 257 (15-16): 2388-2400. doi:10.1016/j.ccr.2013.03.010.
- ^ Schwarz, Klaus; Milne, David B. (22 Ekim 1971). "Growth Effects of Vanadium in the Rat". Science (İngilizce). 174 (4007): 426-428. Bibcode:1971Sci...174..426S. doi:10.1126/science.174.4007.426. PMID 5112000.
- ^ Nickel. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper 22 Eylül 2017 tarihinde Wayback Machine sitesinde arşivlendi.. National Academy Press. 2001, ss. 532-543.
- ^ Srivastava, A. K. (2000). "Anti-diabetic and toxic effects of vanadium compounds". Molecular and Cellular Biochemistry (İngilizce). 206 (206): 177-182. doi:10.1023/A:1007075204494. PMID 10839208.
- ^ Roşin, İ. V. (1967). "Токсикология соединении ванадия, применяемых в современной промышленности". Gigiena i Sanitariya (Rusça). 32 (6): 26-32. PMID 5605589.
- ^ a b "Occupational Safety and Health Guidelines for Vanadium Pentoxide" (İngilizce). İş Güvenliği ve Sağlığı İdaresi. 6 Ocak 2009 tarihinde kaynağından arşivlendi.
- ^ Sax, N. I. (1984). Dangerous Properties of Industrial Materials (İngilizce) (6. bas.). Van Nostrand Reinhold. ss. 2717-2720.
- ^ a b Ress, N. B.; Chou, B. J.; Renne, R. A.; Dill, J. A.; Miller, R. A.; Roycroft, J. H.; Hailey, J. R.; Haseman, J. K.; Bucher, J. R. (1 Ağustos 2003). "Carcinogenicity of Inhaled Vanadium Pentoxide in F344/N Rats and B6C3F1 Mice". Toxicological Sciences (İngilizce). 74 (2): 287-296. doi:10.1093/toxsci/kfg136. PMID 12773761.
- ^ Wörle-Knirsch, Jörg M.; Kern, Katrin; Schleh, Carsten; Adelhelm, Christel; Feldmann, Claus; Krug, Harald F. (2007). "Nanoparticulate Vanadium Oxide Potentiated Vanadium Toxicity in Human Lung Cells". Environmental Science and Technology (İngilizce). 41 (1): 331-336. Bibcode:2007EnST...41..331W. doi:10.1021/es061140x. PMID 17265967.
- ^ Ścibior, A.; Zaporowska, H.; Ostrowski, J. (2006). "Selected haematological and biochemical parameters of blood in rats after subchronic administration of vanadium and/or magnesium in drinking water". Archives of Environmental Contamination and Toxicology (İngilizce). 51 (2): 287-295. doi:10.1007/s00244-005-0126-4. PMID 16783625.
- ^ González-Villalva, Adriana; Fortoul, Teresa I; Avila-Costa, Maria Rosa; Piñón-Zarate, Gabriela; Rodriguez-Lara, Vianey; Martínez-Levy, Gabriela; Rojas-Lemus, Marcela; Bizarro-Nevarez, Patricia; Díaz-Bech, Patricia; Mussali-Galante, Patricia; Colin-Barenque, Laura (Nisan 2006). "Thrombocytosis induced in mice after subacute and subchronic V2O5 inhalation". Toxicology and Industrial Health (İngilizce). 22 (3): 113-116. doi:10.1191/0748233706th250oa. PMID 16716040.
- ^ Kobayashi, Kazuo; Himeno, Seiichiro; Satoh, Masahiko; Kuroda, Junji; Shibata, Nobuo; Seko, Yoshiyuki; Hasegawa, Tatsuya (2006). "Pentavalent vanadium induces hepatic metallothionein through interleukin-6-dependent and -independent mechanisms". Toxicology (İngilizce). 228 (2-3): 162-170. doi:10.1016/j.tox.2006.08.022. PMID 16987576.
- ^ Soazo, Marina; Garcia, Graciela Beatriz (2007). "Vanadium exposure through lactation produces behavioral alterations and CNS myelin deficit in neonatal rats". Neurotoxicology and Teratology (İngilizce). 29 (4): 503-510. doi:10.1016/j.ntt.2007.03.001. PMID 17493788.
- ^ Barceloux, Donald G. (1999). "Vanadium". Clinical Toxicology. 37 (2): 265-278. doi:10.1081/CLT-100102425. PMID 10382561.
- ^ Duffus, J. H. (2007). "Carcinogenicity classification of vanadium pentoxide and inorganic vanadium compounds, the NTP study of carcinogenicity of inhaled vanadium pentoxide, and vanadium chemistry". Regulatory Toxicology and Pharmacology (İngilizce). 47 (1): 110-114. doi:10.1016/j.yrtph.2006.08.006. PMID 17030368.
- ^ Opreskos, Dennis M. (1991). "Toxicity Summary for Vanadium" (İngilizce). Oak Ridge Ulusal Laboratuvarı. 6 Ekim 2021 tarihinde kaynağından arşivlendi.
- ^ Woodyard, Doug (18 Ağustos 2009). Pounder's Marine Diesel Engines and Gas Turbines (İngilizce). Butterworth-Heinemann. s. 92. ISBN 978-0-08-094361-9.
- ^ Totten, George E.; Westbrook, Steven R.; Shah, Rajesh J. (1 Haziran 2003). Fuels and Lubricants Handbook (İngilizce). s. 152. ISBN 978-0-8031-2096-9.
- Genel
- Rehder, Dieter (2008). Bioinorganic Vanadium Chemistry. Inorganic Chemistry (İngilizce) (1. bas.). Hamburg: John Wiley & Sons. ISBN 978-0-470-06509-9.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (İngilizce) (2. bas.). Butterworth-Heinemann. ISBN 0080379419.
- Haynes, W. M., (Ed.) (2017). CRC Handbook of Chemistry and Physics (İngilizce) (97. bas.). CRC Press. ISBN 978-1-4987-5429-3.
Konuyla ilgili yayınlar
- Slebodnick, Carla (1999). "Modeling the Biological Chemistry of Vanadium: Structural and Reactivity Studies Elucidating Biological Function". Hill, Hugh A. O. (Ed.). Metal Sites in Proteins and Models (İngilizce). Springer. ISBN 978-3-540-65553-4.