
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Potasyum, bir kimyasal elementtir. Simgesi K ve atom numarası 19 dur. Potasyum adını izole edildiği Potas olarak da bilinen potasyum karbonattan almıştır. Potasyum yumuşak, gümüş-beyaz renkli alkali bir metaldir. Doğada deniz suyunda ve pek çok mineralde diğer elementlere bağlı olarak bulunur. Havada hızla oksitlenir ve suya karşı da çok aktiftir. Potasyum, pek çok açıdan sodyuma kimyasal olarak benzese de yaşayan organizmalarda, özellikle de hayvan hücrelerinde, sodyumdan farklı muamele görür. Kandaki seviyesinin düşük olmasına hipokalemi, yüksek olmasına hiperkalemi denir.

Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Fenolftalein, soluk sarı renkte, toz halinde bir organik bileşik. Formülü C20H14O4 olup, erime noktası yaklaşık 250 °C'dir. Alkolde çözünür. Fakat suda asla çözünmez. Fenolftalein sıcak sülfürik asit veya çinko klorür katalizörlüğünde fenol ile ftalik anhidridin reaksiyonundan elde edilir.
pH belirteçleri (İndikatörler), çözeltinin pH'sine bağlı olarak renk değiştiren, karmaşık yapıdaki organik bileşiklerdir. Bu tür bileşikler, asit ya da baz titrasyonunun bitiş noktasını saptamak amacıyla kullanılır. pH belirteçlerini asit, baz, redoks ve çöktürme belirteçleri olarak sınıflamak mümkündür.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
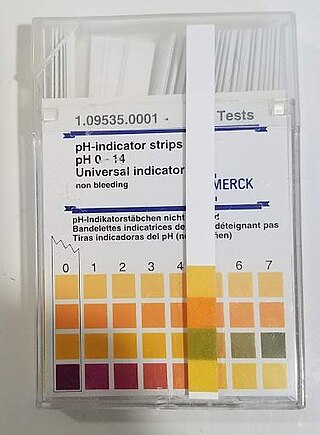
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.

Eozin katrandan elde edilen turuncu-pembe renkli bir boyadır.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).
Alkaliler, suda çözünen bazlardır. Bir alkali çözeltisi, gösterge ilave edilerek tespit edilebilir. Örneğin bir sodyum hidroksit çözeltisi, turnusolü kırmızıdan maviye çevirir. Alkalik çözeltileri, hidroksit iyonları içerir. Asit ve alkali çözeltileri karıştığında, alkalideki hidroksit iyonları asitteki hidrojen iyonlarıyla tepkimeye girer ve suyu meydana getirir. Tuz tepkimenin diğer bir ürünüdür.
Amfoter, oksit ve hidroksitleri asidik ve bazik karakterleri bir arada taşıyan element veya bileşikler. Amfoter maddeler hem asitlerle hem de bazlarla tepkimeye girerler. Metal ve yarı metallerin bir kısmı, aminoasitler ve proteinler amfoterik özellik gösterirler.

Ekstraksiyon, bir çözelti ya da süspansiyon içindeki inorganik veya organik bir maddeyi bir başka çözücü yardımıyla ayırma işlemidir. Kimyada bilinenin aksine bir saflaştırma değil ayırma yöntemi olarak kullanılır.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.
Oksit, içeriğinde en az bir adet oksijen atomu ve en az bir adet başka element içeren bileşiklere verilen genel isimdir. Soy gazlar oksitleri oluşturmazlar. OF2 ve KMnO4 oksit değildir.
Bromtimol mavisi, zayıf asit ve bazlar için kullanınan bir kimyasal pH indikatörüdür.

Kongo kırmızısı, benzidindiazo-bis-1-naftilamin-4-sülfonik asit denilen asidin sodyum tuzudur. İkincil diazo boyasıdır. Kongo kırmızısı suda çözünebilir ancak etanol gibi organik çözücülerde daha iyi çözünür.
Hidronyum (H3O) ;IUPAC'te adlandırılması oksonyum şeklindedir. Bir molekülünde 3 hidrojen ve 1 oksijen atomu bulunur. Hidronyum iyonu, (H3O) asitler suda çözündüklerinde açığa çıkan katyondur. Aynı zamanda asitleri bazlardan ayırmada kullanılır. (Brønsted-Lowry asit-baz teorisi)Bir asit suda çözündüğü zaman hidronyum katyonu ortaya çıkar. Bazı asit çözünme tepkimelerinde kolaylık olması amacıyla (H+) iyonu şeklinde de gösterilse de doğru kullanımı (H3O) şeklindedir. pH'ın belirlemesinde kullanılır. Eğer çözünen maddenin [H+] konsantrasyonu ile [OH-] eşitse o madde nötrdür.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.











