Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.

Çinko, sembolü Zn, atom numarası 30 olan kimyasal bir elementtir. Oda sıcaklığında hafif kırılgan bir metaldir ve oksidasyon giderildiğinde parlak gri bir görünüme kavuşur. Periyodik tablonun 12. (IIB) grubunun ilk elementidir. Bazı açılardan çinko kimyasal olarak magnezyuma benzer: her iki element de yalnızca bir normal oksidasyon durumu (+2) gösterir ve Zn2+ ve Mg2+ iyonları benzer boyuttadır. Çinko, Dünya kabuğundaki en bol bulunan 24. element olup beş kararlı izotopu vardır. En yaygın çinko cevheri, bir çinko sülfür minerali olan sfalerittir.

Kobalt kimyasal bir element'tir. Sembol'ü Co ve atom numarası 27'dir. Nikel gibi kobalt da, doğal meteorik demir alaşımlarında bulunan küçük birikintiler dışında, yer kabuğunda yalnızca kimyasal olarak birleşik formda bulunur. İndirgeyici eritme yoluyla üretilen serbest element sert, parlak, gümüş rengi bir metal'dir.
Klorür, nötr hâldeki klor atomunun, bir elektron alarak iyon (anyon) hâline geçtiğinde aldığı isim. Cl− olarak gösterilir. Klorür iyonu içeren maddelere de verilen bir isimdir. Bir iyon olduğundan dolayı, kendi başına doğada yer almaz; ancak bir çözeltide karşı iyonu ile yer alabilir.

Aseton, propanon ya da dimetil keton, (CH3)2CO formüllü organik kimyasal bileşiktir. Keskin, yanıcı, zehirli olmayan renksiz bir sıvıdır. Çözücü olarak çokça kullanılır. Kapalı formülü C3H6O olarak gösterilir. Su, etanol ve dietil eterle her oranda karışır. Odunun kuru kuruya damıtılmasından, asetat tuzlarının ısıtılmasından ve teknikte izopropil alkolün bakır katalizörlerinden 250 °C'de dehidrojenasyonundan elde edilir. Yağ, boya, kauçuk ve diğer maddelerin çözücüsü olarak kullanılır. Ayrıca izopropil alkol, izopren, kloroform, bromoform, iyodoform ve poli(metil metakrilat) (PMMA) gibi ürünlerin elde edilişinde öncü madde olarak kullanılır. İnsan vücudunda, normal metabolizma ürünü olarak yüksek miktarlarda üretilip atılır.

Anilin, petrolden damıtılarak elde edilen, sıkça ahşap renklendirmesi için kullanılan bir tür boya. Türevleri ilaç yapımında da kullanılan organik bileşik.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.
Kokuşma, ölmüş hayvan bedeninin ayrışmasının yedi aşamasından biridir. Geniş anlamda, dokular arasındaki uyumsuzlukla ve çoğu organın sıvılaşmasıyla sonuçlanan bir süreç içinde, protein yapılarının bozulmasıdır. Organik maddelerin bakterilerle veya mantarlarla ayrışmasından kaynaklanır ve zararlı kokuların oluşumuyla sonuçlanır.

Kekulen, C48H24 kimyasal formülüne sahip polisiklik aromatik hidrokarbon ve sirkülendir. İlk olarak 1978'de sentezlendi ve benzen molekülünün yapısını keşfeden August Kekulé'nin anısına isimlendirildi.

Metil kloroform ya da 1,1,1-trikloroetan C2H3Cl3 formülüne sahip bir kloroalkandır. Doğada bulunmamaktadır, sentetik olarak üretilmiştir. Kloroforma benzeyen bir kokuya sahip olan bu renksiz sıvı bir zamanlar çözücü olarak kullanılmaktaydı ancak ozon tabakasına zararlı olduğu keşfedilince kullanımı terk edilmiştir. Montreal Protokolü nedeniyle 1996 tarihinden sonra kullanımı yasaklanmıştır. 1,1,1-Trikloroetan yeterince stabil olmadığından stabilize edilmesi için içine dioksan gibi bazı maddeler katılır.

Benzoil klorür, benzenkarbonilklorür olarak da bilinen C
6H
5COCl formüllü bir organoklorür bileşiğidir. Bir benzen halkasına bağlanan karbonil grubuna klor bağlanması ile oluşmuştur. Keskin kokulu, dumanlı ve renksiz bir sıvıdır. Suyla tepkimeye girdiğinde hidroklorik asit ve benzoik asit verir. Esas olarak peroksitlerin üretimi için faydalıdır ancak genellikle boyaların, parfümlerin, ilaçların ve reçinelerin hazırlanması gibi diğer alanlarda da faydalıdır.

Organoklorürler, klorlu hidrokarbonlar ya da klorokarbonlar, en az bir adet kovalent bağlanmış klor atomuna sahip organik bileşiklerdir. En basit örnekleri kloroalkanlardır. Organoklorürlerin geniş bir yapısal çeşitliliğe sahip olması onların farklı kimyasal özelliklere, isimlere ve kullanım alanlarına sahip olmasına sebep olmuştur. Bazı organoklorürlerin yararlı olmasına karşın bazıları zehirli ve çevreye zararlıdır.
Benzil klorür, C
6H
5CH
2Cl formüllü organik bileşik. Kimyasal tepkimelerde çokça kullanılan renksiz sıvı. Kaynama noktası 179 °C'dir. Suda çözünmez. Etanol, dietil eter, kloroform ve karbon tetraklorürde çözünür.
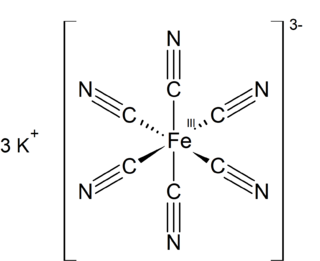
Potasyum ferrisiyanür K3[Fe(CN)6] formülü ile gösterilen inorganik bileşiktir. Bu parlak kırmızı tuz, oktahedral olarak koordine edilmiş [Fe(CN)6]3− iyonu içerir. Suda çözünür ve çözeltisi bir miktar yeşil-sarı flüoresans gösterir. 1822 yılında Leopold Gmelin tarafından keşfedilmiştir ve başlangıçta ultramarin boyalarının üretiminde kullanılmıştır.

Organik kimyada, bir açil klorür (veya asit klorür) -COCl fonksiyonel grubuna sahip bir organik bileşiktir. Formülleri genellikle RCOCl şeklinde yazılır. Burada R bir yan zincirdir. Karboksilik asitlerin reaktif türevleridir. Açil klorürün özgün bir örneği, CH3COCl, asetil klorür'dür. Açil klorürler açil halojenürlerin en önemli alt kümesidir.

Klorobenzen, C
6H
5Cl kimyasal formülüne sahip aromatik bir organik bileşiktir. Bu renksiz, yanıcı sıvı, yaygın bir çözücüdür ve diğer kimyasalların üretiminde yaygın olarak kullanılan bir ara maddedir.
Çinko klorür, ZnCl2·nH2O formülüne sahip, n değeri 0 ila 4,5 arasında değişen hidratlar oluşturan inorganik bir kimyasal bileşiktir. Susuz çinko klorür ve hidratları renksiz veya beyaz kristal katılardır ve suda oldukça çözünür. Beş çinko klorür hidratının yanı sıra dört susuz çinko klorür formu bilinmektedir. Çinko klorürün tüm formları nem çeker. Çinko klorür tekstil işlemede, metalurjik akılarda ve kimyasal sentezde geniş uygulama alanı bulur.