Periyodik tablo, kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur. Dilimizde periyodik tablo, periyodik cetvel, periyodik çizelge, elementler tablosu gibi birçok şekilde isimlendirilmiştir. Bu tablo bilinen bütün elementlerin artan atom numaralarına göre sıralanışıdır. Periyodik cetvelden önce de bu yönde çalışmalar yapılmış olmakla birlikte, mucidi genelde Rus kimyager Dmitri Mendeleyev kabul edilir. 1869'da Mendeleyev atomları artan atom ağırlığına göre sıraladığında belli özelliklerin tekrarlandığını fark etti. Özellikleri tekrarlanan elementleri alt alta yerleştirdi ve buna grup adını verdi.

Hidrojen, sembolü H, atom numarası 1 olan kimyasal bir element. Standart sıcaklık ve basınç altında renksiz, kokusuz, metalik olmayan, tatsız, oldukça yanıcı ve H2 olarak bulunan bir diatomik gazdır. 1,00794 g/mol'lük atomik kütlesi ile tüm elementler arasında en hafif olanıdır. Periyodik cetvelin sol üst köşesinde yer alır. Hidrojenin adı, Yunancada "su oluşturan" anlamına gelen ὑδρογόνο'dan (idrogono) kelimesinden gelir.

Helyum, sembolü He ve atom numarası 2 olan kimyasal element. Periyodik cetvelin birinci periyot 8A grubunda yer alan bir gazdır. Kokusuz, renksiz bir gazdır ve yanmaz.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

Kükürt, simgesi S, atom numarası 16 olan, limon sarısında ametal, yalın katı bir elementtir.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Tiyoesterler genel formülü R-S-CO-R' olan kükürtün bir asil grup ile bağlanması sonucu oluşan bileşiklerdir. Bir karboksilik asit ile bir tiyol arasındaki esterleşmenin ürünleridirler.
Organosülfür bileşikler veya organik kükürt bileşikleri, kükürt içeren organik bileşiklerdir. Genellikle kötü kokulu olmalarına karşın, organosülfür türevleri denilen birçok tatlı bileşik de vardır. Sülfür yıldızlararası uzay, sıcak asidik volkanların içi ve okyanusların derinlikleri de dahil olmak üzere doğada bol miktarda bulunurlar. Kükürt yaşam için gereklidir. 20 yaygın amino asitin ikisi ve penisilin ve sülfonamid gibi bazı antibiyotikler organosülfür bileşikleridir. Ayrıca enzimler, koenzimler, vitaminler ve hormonlarda da bulunurlar. Sülfür içeren antibiyotikler pek çok hayat kurtarmasına rağmen bir organosülfür bileşik olan hardal gazı ölümcül kimyasal savaş ajanıdır. Fosil yakıtlar; kömür, petrol ve doğalgaz mutlaka organokükürt bileşikler içerirler. Bunların uzaklaştırılması (desülfürizasyon) petrol rafinerileri için önemli bir konudur.
Organofosfor bileşikleri, karbon-fosfor bağı ihtiva eden çözülebilir organik bileşiklerdir. Doğal çevrede uzun süre kalan ve temel olarak haşere kontrolü için kullanılan klorlanmış hidrokarbonlara alternatif olarak kullanılırlar. Organofosfor kimyası organofosforlu bileşiklerin özelliklerini ve reaktivitelerini inceleyen bilim dalıdır. Fosfor; azot ile birlikte periyodik tabloda 5. grupta yer aldığından dolayı fosfor bileşikleri ve azot bileşikleri çok benzer özelliklere sahiptirler.

Sodium alüminat önemli bir ticari inorganik kimyasaldır. Alüminyum hidroksitin üretiminde önemli ve kabul gören bir kaynaktır. Saf susuz sodyum alüminat beyaz kristal halde bulunmaktadır ve molekül formülü NaAlO2, NaAl(OH)4 (hidrat), Na2O·Al2O3 veya Na2Al2O4 olarak geçmektedir. Ticari sodyum alüminat toz halde veya sulandırılmış halde bulunabilir.
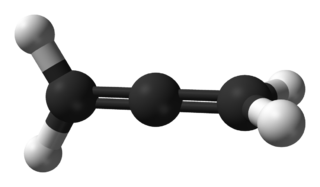
Propadien H2C=C=CH2 formülüne sahip organik bileşik. İki komşu C=C çift bağına sahip en basit bileşik ve allendir. MAPP gazının bir bileşeni olarak kaynak için yakıt olarak kullanılır.
Polisülfürler kükürt atom zincirleri içeren bir sınıf kimyasal bileşiklerdir. Polisülfürler iki ana sınıfa ayrılır: anyonlar ve organik polisülfürler. Anyonlar S2−ngenel formülüne sahiptir. Bu anyonlar hidrojen polisülfürlerin H2Sn konjüge bazlarıdır. Organik polisülfürler genellikle RSnR formülüne sahiptir, burada R = alkil veya arildir.
Florosülfürik asit (IUPAC adı: sülfürofloridik asit), HSO3F kimyasal formüllü bir inorganik bileşiktir. Ticarî olarak temin edilebilen en güçlü asitlerden biridir. HSO3F formülü sülfürik asit (H2SO4) ile ilişkisini vurgulamaktadır. HSO3F tetrahedral bir moleküldür. Ticari numuneler genellikle sarı olmasına rağmen renksiz bir sıvıdır.
Disülfür diklorür S
2Cl
2 formüllü kükürt ve Klor bileşiğidir.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.
Tvistan (IUPAC adı: trisiklo [4.4.0.0 3,8] dekan), bir bir organik bileşiktir ve C10H16 formülü ile gösterilir. Bir sikloalkandır ve en basit diamondoid olan adamantanın izomeridir ve aynı adamantan gibi çok uçucu değildir. Tvistan, halkalarının "büküm teknesi" olarak bilinen sikloheksan konformasyonuna kalıcı olarak zorlanması sebebiyle (twist: bükmek) adlandırıldı. Bileşik ilk olarak 1962'de Whitlock tarafından rapor edilmiştir.

Elektron iyonizasyonu, enerjik elektronların iyonlar üretmek için katı veya gaz fazı atomları veya molekülleri ile etkileşime girdiği bir iyonizasyon yöntemidir. EI, kütle spektrometrisi için geliştirilen ilk iyonizasyon tekniklerinden biriydi. Ancak bu yöntem hala popüler bir iyonizasyon tekniğidir. Bu teknik, iyonları üretmek için yüksek enerjili elektronlar kullandığı için sert bir iyonizasyon yöntemi olarak kabul edilir. Bu, bilinmeyen bileşiklerin yapı tespiti için yardımcı olabilecek kapsamlı parçalanmaya yol açar. EI, moleküler ağırlığı 600'ün altında olan organik bileşikler için en yararlı olanıdır. Aynı zamanda, katı, sıvı ve gaz halindeki birkaç başka termal olarak kararlı ve uçucu bileşik, çeşitli ayırma yöntemleriyle birleştirildiğinde bu tekniğin kullanılmasıyla tespit edilebilir.

Koku, aroma, koku veya tat olarak da bilinen aroma bileşiği, koku veya kokuya sahip kimyasal bir bileşiktir. Tek bir kimyasal veya kimyasal bileşikler sınıfının bir koku vermesi için, burnun üst kısmındaki hava yoluyla koku alma sistemine geçiş için yeterince uçucu olması gerekir. Çeşitli kokulu meyveler çeşitli aroma bileşiklerine özellikle çekici aromalara sahip olacak şekilde ticari olarak yetiştirilen ve birkaç yüz aroma bileşiği içeren çilekler bunlara örnektir.

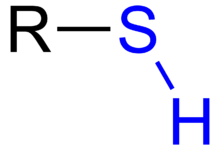
Tiyoeter ya da organik sülfür, R−S−R' bağlantısına sahip bir organosülfür fonksiyonel grubudur. Kükürt içeren çoğu bileşikler gibi uçucudurlar.

Perklorometil merkaptan, CCl3SCl formülüne sahip organosülfür bileşiğidir. Esas olarak boyalar ve fungisitlerin (captan, folpet) üretiminde bir ara madde olarak kullanılır. Ticari numunelersarımsı renkte olmasına rağmen saf bileşik renksiz bir yağdır. Suda çözünmez fakat organik çözücülerde çözünür. Kötü, dayanılmaz, keskin bir kokusu vardır. Perklorometil merkaptan orijinal adıdır, sistematik adı triklorometansülfenil klorür olmalıdır çünkü bileşik bir merkaptan değil, bir sülfenil klorürdür.