
Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz hâlinde bulunan bileşiğin adıdır. Renk ve kokusu yoktur. Kimyasal formülü CO2 şeklinde olup molekül ağırlığı 44,009 g/mol'dür. Karbon içeren besin maddelerinin metabolize edilmesi sonucu meydana gelen bir son üründür. Küresel ısınmada önemli bir pay sahibidir. Yerden yansıyan güneş ışınlarının atmosferden çıkma oranını azaltır.

Pigment ya da boyar madde, suda tamamen veya hemen hemen çözünmeyen renkli bir malzemedir. Bunun tersine, boyalar genelde, en azından kullanımlarının bir aşamasında çözünürdür. Boyalar genellikle organik bileşik pigmentler ise genellikle inorganik bileşikdir. Tarih öncesi ve tarihi değeri olan pigmentler arasında koyu sarı, odun kömürü ve lapis lazuli bulunur. Sanayide olduğu kadar sanatta da kalıcılık ve istikrar istenen özelliklerdir. Kalıcı olmayan pigmentler kaçak olarak adlandırılır. Kaçak pigmentler zamanla veya ışığa maruz kaldıkça solarken bazıları sonunda kararır. Pigmentler boya, mürekkep, plastik, kumaş, kozmetik, gıda ve diğer malzemeleri renklendirmede kullanılır. İmalat ve görsel sanatlarda kullanılan çoğu pigment kuru renklendiricidir ve genellikle ince bir toz hâlinde öğütülür. Boyada kullanım için bu toz, pigmenti askıya alan görece nötr veya renksiz bir malzeme olan bağlayıcıya eklenir ve boyaya yapışkanlık verir. Genellikle aracında çözünmez olan bir pigment ile kendisi bir sıvı olan veya aracında çözünen boya arasında bir ayrım yapılır. Renklendirici, ilgili araca bağlı olarak bir pigment veya bir boya görevi görebilir. Bazı durumlarda pigment, bir metalik tuzla çözülebilir bir boyanın çökeltmesi ile boyadan üretilebilir. Oluşan pigmente göl pigmenti denir. Biyolojik pigment terimi, çözünürlüklerinden bağımsız olarak tüm renkli maddeler için kullanılır.
Titanyum sembolü Ti olan 22 atom numaralı kimyasal elementtir.

Kobalt kimyasal bir element'tir. Sembol'ü Co ve atom numarası 27'dir. Nikel gibi kobalt da, doğal meteorik demir alaşımlarında bulunan küçük birikintiler dışında, yer kabuğunda yalnızca kimyasal olarak birleşik formda bulunur. İndirgeyici eritme yoluyla üretilen serbest element sert, parlak, gümüş rengi bir metal'dir.
Toryum; sembolü Th, atom numarası 90 olan zayıf radyoaktivite gösteren, metalik, kimyasal bir elementtir. Toryum havaya maruz kaldığında kararır ve toryum dioksit oluşturur; orta derecede yumuşak, işlenebilir ve yüksek bir erime noktasına sahiptir. Toryum, kimyasına +4 oksidasyon durumunun hakim olduğu elektropozitif bir aktinittir; oldukça reaktiftir ve ince bir şekilde bölündüğünde havada tutuşabilir.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.

Kalsiyum hidroksit, sönmemiş kirece su ilave edilmesiyle elde edilen kimyasal bileşiktir. Kristal beyaz renkli toz halde bulunur. Suda çözündüğünde hamurumsu görüntü veren bir alkalidir. Geleneksel adı söndürülmüş kireç veya hidratik kireçtir.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
Kalsiyum oksit (CaO) ya da sönmemiş kireç geniş bir kullanım alanı bulunan bir çeşit kimyasal bileşiktir. Beyaz renkli, aşındırıcı ve alkalik bir katıdır. Sanayide kireç taşlarını yüksek sıcaklıklarda eriterek karbondioksidin uzaklaştırılmasıyla elde edilir. Suyla reaksiyona girerse oksitlenir ve kalsiyum hidroksidi oluşturur.

Kalsiyum karbonat, halk arasında kireç taşı olarak bilinen bir tür kimyasal bileşiktir. Bileşik formülü CaCO3 şeklindedir. Bu bileşik doğada en fazla eski kayaçlarda ve deniz kabuklarında bulunur. Kalsiyum karbonat, antiasitlerin bir üyesi olsa da, fazlası biyolojik olarak zararlıdır.

Baryum nitrat kimyasal formülü Ba(NO3)2 olan baryum ve nitrat iyonundan meydana gelmiş bir tuzdur.

Silisyum dioksit veya silika, oksijen ve silisyum içeren kimyasal bileşik. Kimyasal formülü SiO2'dir. 16. yüzyıldan beri bilinmektedir. Cam, beton, fayans, porselen gibi birçok maddede kullanılmaktadır. SiO2, daha çok herhangi bir malzeme yerine, kristalin formları (polimorf) şeklinde bulunmaktadır. Kuvars, topaz ve ametist gibi 17 farklı kristal formu vardır.

Kalsiyum arsenat, Ca3(AsO4)2 formülüne sahip inorganik bileşiktir. Renksiz bir katı, başlangıçta bir pestisit ve mikrop öldürücü madde olarak kullanılmıştır.Kurşun arsenat ile karşılaştırıldığında, suda oldukça çözünür, bu da daha toksik hale getirir. Mineraller Rauenthalit Ca3(AsO4)2·10H2O ve Phaunouxite Ca3(AsO4)2·11H2O, kalsiyum arsenat hidratlarıdır.

Titanyum diborür (TiB2), mükemmel ısı iletkenliği, oksidasyon (yükseltgenme) kararlılığı ve mekanik erozyona karşı direnç içeren çok sert bir seramiktir. TiB2 ayrıca makul bir elektrik iletkenidir.

Çinko oksit, ZnO formülü ile gösterilen bir inorganik bileşik. ZnO, suda çözünmeyen beyaz bir tozdur ve yaygın olarak kauçuk, plastik, seramik, cam, çimento, yağlayıcı, boya, merhem, yapıştırıcı, sızdırmazlık maddesi, pigment, yiyecekler, bataryalar, ferritler, yangın geciktiriciler ve ilk yardım bantları gibi kullanım alanlarına sahiptir. Mineral çinkoit, doğal olarak meydana gelmesine rağmen, çoğu çinko oksit sentetik olarak üretilir.

Kurşun(IV) oksit, PbO2 formülüne sahip inorganik bileşiktir. Kurşunun +4 yükseltgenme durumunda olduğu bir oksittir. Suda çözünmeyen koyu kahverengi bir katıdır. İki kristal formda bulunur. Elektrokimyada, özellikle kurşun asit akülerin pozitif plakası olmak üzere birçok önemli uygulamaya sahiptir.

Klor triflorür, formülü ClF3 olan interhalojen bir bileşiktir. Zehirli, aşındırıcı ve aşırı reaktiftir. Gaz hâlindeyken renksizken sıvı hâlindeyken solgun yeşilimsi sarı renktedir. Yarı iletken sanayiinde, nükleer yakıtların yeniden işlenmesinde, roket itici yakıtlarında ve diğer endüstriyel alanlarda kullanılır. Benzen, toluen, eter, alkol, asetik asit, hekzan gibi çözücüler ile reaksiyona girer. Karbon tetraklorürde çözünür ancak yüksek konsantrasyonlarda patlayıcı olabilir.
Uranyum Dioksit, diğer adıyla uranya kimyasal formülü UO2 olan maddedir. Neredeyse siyah renkli veya koyu kahverengi, radyoaktif ve kristal yapıda olan bir madde olup doğal olarak uraninit ve kleveyit minerallerinde bulunmaktadır. Nükleer santrallerde plütonyum ve uranyum dioksit karışımı yakıt çubuklarında kullanılmaktadır. Sarı ve siyah renkli seramiklerde 1960 yılına kadar kullanılmışlardır. Stoksiyometrik özelliklerine bağlı olarak erime sıcaklığı değişkendir.
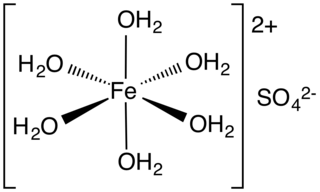
Demir (II) sülfat veya demir sülfat FeSO4•xH2O formülüne sahip bir dizi tuz anlamına gelir. Bu bileşikler en yaygın olarak heptahidrat (x = 7) olarak bulunursa da x için birkaç değer bilinmektedir. Hidratlı form tıp alanında demir eksikliğini tedavi etmek ve ayrıca endüstriyel uygulamalar için kullanılır. Antik çağlardan beri, Zaç-ı Kıbrıs ve yeşil vitriyol (vitriyol, sülfat için eski bir isimdir) olarak bilinen, mavi-yeşil heptahidrat (7 molekül su içeren hidrat) bu maddenin en yaygın şeklidir. Tüm demir (II) sülfatlar suda çözünerek oktahedral moleküler geometriye sahip ve paramanyetik olan aynı akua kompleksi [Fe(H2O)6]2+ verir.
1,1-Dikloroetilen (1,1-DCE) veya viniliden klorür, C
2H
2Cl
2 moleküler formülüne sahip bir organoklorürdür. Keskin bir kokuya sahip renksiz bir sıvıdır. Çoğu klorokarbon gibi suda az çözünür, ancak organik çözücülerde çözünür. 1,1-DCE, gıda kullanımları için streç film Saran'ın öncüsüydü, ancak bu uygulama aşamalı olarak kaldırıldı.

















