
Arsin AsH3 formüllü inorganik bileşik. Bu yanıcı ve fazlaca zehirli gaz, arsenik elementinin en basit bileşiklerinden biridir.
Titanyum sembolü Ti olan 22 atom numaralı kimyasal elementtir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.
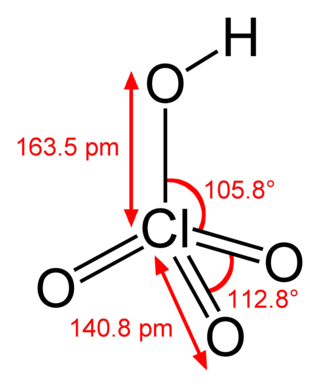
Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.
Periyodik asit iyotun en yüksek oksoasitidir. Bütün periodatlar gibi iki form halinde var olur: H5IO6 formülü ile gösterilen ortoperiyodik asit ve HIO4 formüllü ile gösterilen metaperiyodik asit.
Sodyum hipobromit NaBrO formülüne sahip inorganik bir bileşiktir. Genellikle suyun kristalize edilmesiyle elde edildiğinden genel formülüne NaBrO.5H2O de denebilir. Sarı-turuncu renge sahip suda çözünebilir bir maddedir. İyonları Na+ BrO-'dur.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.

Hipofloröz asit, kimyasal formül HOF, florun bilinen tek oksoasididir. Hipofloritlerde oksijenin oksidasyon durumu 0'dır. Aynı zamanda katı olarak izole edilebilen tek hipohaloid asittir. HOF, suyun, hidrojen florür, oksijen diflorür, hidrojen peroksit, ozon ve oksijen üreten flor ile oksidasyonunda bir ara maddedir. HOF oda sıcaklığında patlayıcıdır, HF ve O2 oluşturur:
- 2 HOF → 2 HF + O2

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.

Tellüröz asit, H2TeO3 formülüne sahip bir inorganik bileşiktir. Tellürün (IV) oksoasididir. Bileşik iyi karakterize edilmemiştir. Formülünü yazmanın alternatif bir yolu (HO)2TeO'dur. Prensip olarak, tellüröz asit, tellür dioksitin su ile, yani hidrolizle işlenmesiyle oluşacaktır. İlgili konjugat bazı, potasyum hidrojen tellürit (KHTeO3) gibi çeşitli tuzlar formunda iyi bilinmektedir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.
Disülfür diklorür S
2Cl
2 formüllü kükürt ve Klor bileşiğidir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.

Silisyum tetraklorür veya tetraklorosilan, SiCl
4 formülüne sahip inorganik bileşiktir. Havada duman çıkaran renksiz uçucu bir sıvıdır. Ticari uygulamalara yönelik yüksek saflıkta silisyum ve silika üretmek için kullanılır. Klorosilan ailesinin bir parçasıdır.

Germanyum tetraklorür, asidik bir kokuya sahip, renksiz, dumanlı bir sıvıdır. Saflaştırılmış germanyum metalinin üretiminde ara madde olarak kullanılır. Son yıllarda fiber optik üretiminde reaktif olarak kullanılması nedeniyle GeCl4 kullanımı önemli ölçüde arttı.













