Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.

Isı, belirli sıcaklıktaki bir sistemin sınırlarından, daha düşük sıcaklıktaki bir sisteme, sıcaklık farkı nedeniyle geçen enerjidir. Isı, parçacıkların 40.000-400.000 hz./s titreşmesi ile oluşur. Isı da iş gibi bir enerji akışı biçimidir. Isı sistem sınırlarında ve geçiş durumunda iken belirlenebilir. Isı sistemin bir durum fonksiyonu değildir.

Entalpi, maddenin yapısında depoladığı her türden enerjilerin toplamıdır. H ile simgelenir. Bir mol maddede depolanmış enerjiye o maddenin molar entalpisi denir.

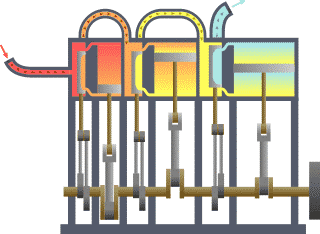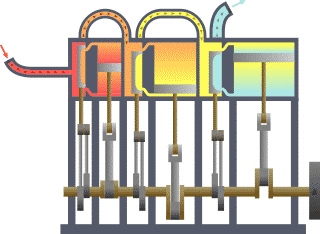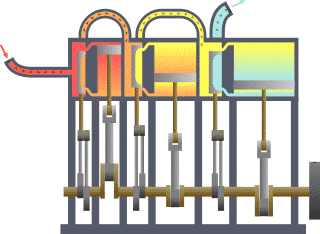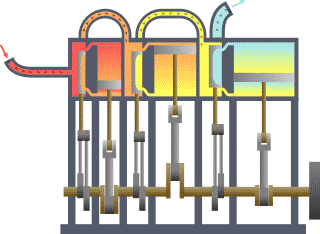
Termodinamik çevrim, bir veya daha çok hal değişimi gerçekleştiren, iş veya enerji üreterek veya enerjiyi transfer ederek ilk haline dönen bir çalışma akışkanı içeren çevrimlerdir. Tabloda termodinamik çevrimlerin listesi verilmiştir.

Entropi, fizikte bir sistemin mekanik işe çevrilemeyecek termal enerjisini temsil eden termodinamik terimidir. Çoğunlukla bir sistemdeki rastgelelik ve düzensizlik (kaos) olarak tanımlanır ve istatistikten teolojiye birçok alanda yararlanılır. Sembolü S'dir.
Ekserji, Termodinamik bir sistemin ihtiva ettiği potansiyel enerjisinin, herhangi bir referans haline göre kullanılabilirliğinin bir göstergesidir. Ekserji tersinir bir süreç sonucunda sistem çevre ile denge sağladığı takdirde, oluşan entropi sonucu kullanılamaz hale gelen enerji düşüldükten sonra, teorik olarak elde edilebilecek maksimum faydalı iş miktarı olarak da tanımlanabilir. Sistem enerjetiğinde ise ekserji entropiden arındırılmış enerji olarak tanımlanır.
Termodinamiğin(Isıldevinimin) ikinci yasası, izole sistemlerin entropisinin asla azalamayacağını belirtir. Bunun sebebini izole sistemlerin termodinamik dengeden spontane olarak oluşmasıyla açıklar. Buna benzer olarak sürekli çalışan makinelerin ikinci kanunu imkânsızdır.

Termodinamik yasaları, termodinamiğin temelini oluşturan dört yasadır. Termodinamik proseslerdeki ısı ve iş transferlerinin yapısını tanımlar.
Bölüşüm fonksiyonu termodinamik dengede olan bir sistemin istatistiksel özelliklerini tanımlar. Sıcaklığın ve hacim, molekül sayısı gibi diğer parametrelerin fonksiyonudur. Toplam enerji, entropi ve basınç gibi termodinamik değişkenler bölüşüm fonksiyonu cinsinden veya türevleri cinsinden ifade edilebilir.
Termal enerji, ortam veya sistem sıcaklığı sonucunda ortamdaki veya sistemdeki bir cismin veya maddenin potansiyel ve kinetik enerjileri toplamını ifade eden bir enerji biçimidir. Sistemde sıcaklık olmadığı müddetçe bu niceliği tanımlamak zor ve hatta anlamsız olabilir. Bu durumda herhangi bir termal iş söz konusu değildir.

Enerji dönüşümü enerjinin bir biçimden diğerine dönüşümüdür. Fizikte enerji terimi bir sistemdeki belirli değişiklikleri oluşturma kapasitesini açıklar. Dönüşümde entropinin sınırlamaları göz ardı edilir. Sistemlerin toplam enerji dönüşümü, yalnızca enerjinin eklenmesi veya çıkarılması ile sağlanabilir. Termodinamiğin birinci kanununa göre enerji, dönüştürülebilen bir büyüklüktür. Bir sistemin toplam kütle miktarı, enerjisinin bir ölçüsüdür. Bir sistemdeki enerji dönüştürülebildiğinden dolayı, farklı bir hale veya başka bir biçime dönüşebilir. Çoğu haldeki enerji, birçok fiziksel iş yapmak için kullanılabilir. Enerji doğal süreçler veya makinelerde kullanılabilir. Ayrıca ısı, ışık veya harekete dönüşebilir. Örneğin bir güneş pili, güneş ışınımını elektrik enerjisine dönüştürür ve böylece ampul yanar veya bilgisayara güç sağlanır.
Fermi enerjisi, elektronların toplam kimyasal potansiyeli ya da elektrokimyasal potansiyeli olarak tanımlanır ve µ veya  şeklinde gösterilir. Bir cismin Fermi seviyesi, bir termodinamik miktardır ve termodinamik iş, cisme bir elektron eklemeye ihtiyaç duyduğundan ötürü, Fermi seviyesi önemlidir. Fermi seviyesinin açık bir şekilde anlaşılması-elektronik özelliklerin belirlenmesinde Fermi seviyesinin elektronik bağ yapısı ile olan ilişkisi ve bir elektronik devrede Fermi seviyesinin voltaj ve yük akışı ile olan ilişkisi- katı hal fiziğinin anlaşılması için gereklidir.
şeklinde gösterilir. Bir cismin Fermi seviyesi, bir termodinamik miktardır ve termodinamik iş, cisme bir elektron eklemeye ihtiyaç duyduğundan ötürü, Fermi seviyesi önemlidir. Fermi seviyesinin açık bir şekilde anlaşılması-elektronik özelliklerin belirlenmesinde Fermi seviyesinin elektronik bağ yapısı ile olan ilişkisi ve bir elektronik devrede Fermi seviyesinin voltaj ve yük akışı ile olan ilişkisi- katı hal fiziğinin anlaşılması için gereklidir.

Termodinamik'in üçüncü yasası bazen ‘mutlak sıfır sıcaklığında dengede olan sistemlerin özelliklerine ilişkin’ olarak şu şekilde tanımlanır:

Termal ve istatistiksel fizik felsefesinde, Brownian ratchet ya da Feynman-Smoluchowski ratchet 1912 tarihinde Polonyalı fizikçi Marian Smoluchowski tarafından analiz edilen ve 11 Mayıs 1962 tarihinde, Kaliforniya teknoloji enstitüsünde, Nobel Ödülü kazanmış Amerikan fizikçi Richard Feynman tarafından bilinir hale getirilen görünür devridaim makinedir. Bu basit makine küçük kısa kürekler ve mandallı çark içerir. Maxwell'in cini olarak görülse de, termal denge sistemindeki gelişigüzel dalgalanmadan işten kazanç sağlayabilmek için kullanılır. Termodinamiğin ikinci yasası ihlali, termal denge sistemindeki gelişigüzel dalgalanmayı kapsar. Detaylar Feynman ve diğerleri tarafından analiz edilmiş ve neden bunu yapamadığını göstermişlerdir.
Fizikte kara delik termodinamiği, termodinamik kanunlarını kara deliğin olay ufkuyla bağdaştırmaya çalışan bir araştırma alanıdır. Kara delik ışınımının istatistiksel mekanik konusu, kuantum mekaniğinin gelişmesini sağlar. Kara delik ışınımının istatistiksel mekanik konusunu anlamaya çalışmak, bu konunun kuantum yer çekimi konusunu anlamamızda büyük etkisi olacaktır. Ayrıca holografi ilkesini anlamamızı sağlayacaktır.
Enerji bilimi temelinde enerji dönüşümlerini inceleyen bilim dalıdır. Enerji bütün ölçülerde akar çok küçük kuantum seviyesinden kainat ve biyosfere kadar çok geniş bir disiplindir. Termodinamik, kimya, biyolojik enerji, biyokimya, ekolojik enerji gibi birçok bilim dalını kapsamaktadır. Enerjinin her dalı, sabit bir tartışmayla başlar ve biter. Örneğin Lehninger (1973) termodinamiğin çeşitli enerji enerji değişimleriyle ilgilenmesinden dolayı enerji bilimi olarak tanımlanabileceğini öne sürmüştür.
Termodinamiğin sıfırıncı kanunu şöyle ifade edilir: Eğer iki termodinamik sistemin her biri üçüncü ile termal bir dengedeyse o zaman bu üçü birbiriyle termal denge içerisindedir.
Biyolojik Termodinamik, hücrelerin, yapıların, organizmaların arasında veya içinde gerçekleşen enerji dönüşümlerini ve bu dönüşümlerin temelini oluşturan kimyasal süreçlerin işleyişini inceleyen kantitatif (sayısal) bir daldır. Biyolojik Termodinamik herhangi belirli bir fenotipik nitelikle özdeşleşen kazancın gerekli olan enerjiyle değişimine değip değmeyeceği sorusunu sorabilir.
Termodinamikte izovolümetrik süreç veya izometrik süreç olarak da adlandırılan izokorik süreç kapalı sistem hacminin sabit kalması demektir. İzokorik bir süreç, kapalı, elastik olmayan bir kabın içeriğinin ısıtılması veya soğutulması ile örneklendirilebilir. Kapalı sistem kabın içeriğinin dışarıya karşı izole olmasıdır. Kap deforme olmaz ve hacmi termodinamik süreç boyunca sabit kalırsa bu bir izokorik süreç örneğidir.























