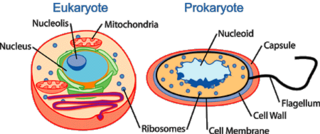
Telomer
Telomer, ökaryotik doğrusal kromozomların uçlarında bulunan, herhangi bir gen kodlamayan, özelleşmiş heterokromatin yapılarıdır.

Telomerlerin varlığı, kromozomların uçlarının rastgele çift zincir DNA kırılmalarından koruyarak istenmeyen kromozom uçlarının birleşmesinden ya da kromozomu nükleolitik parçalanmadan korur. Kromozomların bu fiziksel korunmasının dışında, ökaryotik telomerleri, kromatin organizasyonu, kromozomların replikasyonu ve hücre çoğalması gibi önemli hücresel görevleri vardır.[1]
Memeli telomerleri, canlı türüne, hücre türüne ve genetik geçmişe bağlı olarak 1–50 kb telomerik DNA'ya sahip olabilir. İnsan telomerleri, üreme hücrelerinde 10–15 kb’dır, fakat bazı somatik hücrelerde ve genellikle kanser hücrelerinde daha kısadır.[2] Bu uç diziler çok iyi korunmuşlardır.
İnsan telomerleri, kromozomun uç bölgesinde bulunan ve çift iplikli arka arkaya tekrarlanan 3’ TTAGGG hekzanükleotid dizisinden oluşurlar.[3] Bu hekzanükleotid dizileri, kement şeklinde ilmik oluşturan (T-loop) 100–200 nükleotitlik G-zengini (G-kuyruğu) sarkan 3’ tek iplikli TTAGGG dizisiyle sonlanırlar.[4]
Yapıları

Telomerlerin kendine özgü olan T-loop düzeni, telomerin kendi üzerine kıvrılmasıyla oluşur. Tek iplikli sarkan (overhanging) Guanin zengini tek iplik (G-kuruğu) çift iplikli telomerin “içine” girer. Bu yapı da telomer ipliklerinden birinin yerine geçerek ikinci bir ilmek olan d-loop’u oluşturur. Bu t-loop ve d-loop yapıları, telomeri diğer kromozomlarla uç uca birleşmelerden ve telomerleri kromozom kırıkları olarak algılayıp telomer tamirini başlatan hücre döngüsü kontrol noktalarından korur.[5]
Özellikle Telomerik DNA’da bulunan proteinler, ikili telomer bağlanma proteinleri olan TRF1 ve TRF2’dir. TRF1, TRF2 ve ilişkili oldukları proteinler, kompleksin oluşmasından ve T-loop oluşumundan başlıca sorumlu proteinlerdir. TRF1, intratelomerik kıvrımlarda önemlidir ve telomer uzunluğunu düzenler. TRF1’in fazla üretilmesi telomerlerin kısalmasına, inhibisyonu ise telomerin uzamasına sebep olur. TRF2 telomer uzunluğu boyunca bağlanır fakat T-loop yakınında fazla bulunur ve bu da T-loop oluşumu ve stabilizasyonu için önemlidir. Bu iki proteinin işbirliği, iki elin bir düğüm atmasına benzer, ilk el (TRF1) ilmeği (loop) oluşturur ve ikinci el (TRF2) ipliği sıkar ve korur.[5]
Hücre yaşlanması ve Telomerler
Telomerler her hücre döngüsünde ortalama 50–150 baz çifti azalır.[6] Bu telomer kısalması sonuçta, hücre bölünme sayısını kısıtlar. Son zamanlarda yapılan gözlemler, telomerlerin düzenlenmesinin birçok ökaryotik hücrenin hücre döngüsünde önemli bir etken olduğunu ortaya koymuştur.[7] Telomerik birleşmeler, mitoz sırasında kırılan disentrik kromozomların oluşmasına sebep olarak kromozom köprülerinin, kırıklarının ve birleşmelerin oluşmasını sağlarlar. Sonuçta hayatta kalan hücrelerin genomlarında değişiklikler olur. Fonksiyonel olmayan kromozom uçları ve genomdaki dengesizlik ayrıca telomer uzunluğunda değişiklik olmasına sebep olur. Bu da, hücre yaşlanması kontrolünde hızlanmaya ya da gecikmeye sebep olur. Bu yüzden fonksiyonel olmayan telomerler, genetik bilginin kaybolmasına, yeniden düzenlenmesine ya da dengesinin kaybolmasına sebep olur. Bu genomik değişiklikler de sonuçta hem kansere hem de fenotipin yaşlanmasına sebep olur.[2]
Hücre bölünmesinin devamlılığını sağlamak için üreme hücrelerinde, klonal gelişme gösteren lenfositlerde ve ölümsüz kanser hücrelerinde telomerlerin korunması gerekmektedir. Telomer uzunluğunun korunmasını sağlayan en bilinen yöntem, telomerlerin de novo olarak üretilmesi ve telomeri kapaması için telomerazın verilmesidir.
Ayrıca bakınız
Dış bağlantılar
- Telomer ve hücre yaşlanması
- Telomer replikasyonu ve hücre yaşlanması3 Nisan 2007 tarihinde Wayback Machine sitesinde arşivlendi.
Kaynakça
- ^ Wong JM, Collins K: Telomere maintenance and disease. Lancet 2003, 362(9388):983-988. PMID 14511933
- ^ a b Rodier F, Kim SH, Nijjar T, Yaswen P, Campisi J: Cancer and aging: the importance of telomeres in genome maintenance. The International Journal of Biochemistry & Cell Biology, 2005, 37(5):977-990 PMID 15743672
- ^ Biroccio A, Leonetti C: Telomerase as a new target for the treatment of hormone-refractory prostate cancer. Endocrine-Related Cancer 2004, 11(3):407-421. PMID 15369445
- ^ Bayne S, Liu JP: Hormones and growth factors regulate telomerase activity in ageing and cancer. Molecular and Cellular Endocrinology 2005, 240(1-2):11-22. PMID 16005142
- ^ a b Granger MP, Wright WE, Shay JW: Telomerase in cancer and aging. Critical reviews in oncology/hematology 2002, 41(1):29-40. PMID 11796230
- ^ Reddel RR: Alternative lengthening of telomeres, telomerase, and cancer. Cancer letters 2003, 194(2):155-162. PMID 12757973
- ^ Masutomi K, Hahn WC: Telomerase and tumorigenesis. Cancer Letters, 2003, 194 (2): 163-172 PMID 12757974