Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Periyodik tablo, kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur. Dilimizde periyodik tablo, periyodik cetvel, periyodik çizelge, elementler tablosu gibi birçok şekilde isimlendirilmiştir. Bu tablo bilinen bütün elementlerin artan atom numaralarına göre sıralanışıdır. Periyodik cetvelden önce de bu yönde çalışmalar yapılmış olmakla birlikte, mucidi genelde Rus kimyager Dmitri Mendeleyev kabul edilir. 1869'da Mendeleyev atomları artan atom ağırlığına göre sıraladığında belli özelliklerin tekrarlandığını fark etti. Özellikleri tekrarlanan elementleri alt alta yerleştirdi ve buna grup adını verdi.

Element, aynı cins atomlardan oluşan ve kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere verilen isimdir.

Hiroşima, Japonya'nın Hiroşima prefektörlüğünün merkezi ve Chūgoku bölgesinin en büyük şehridir. Şehrin adı Japoncada "geniş ada" anlamına gelmektedir. Yüzölçümü 905.01 km² dir.

Atom veya ögecik, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada "bölünemez" anlamına gelen "atomos"tan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Kimyasal elementlerin atom numarası, o elementin her atomunun çekirdeğinde bulunan proton sayısıdır. Atomda bulunan proton sayısı elementin kimyasal karakteri hakkında da bilgi verir.

Nükleer silah, nükleer reaksiyon ve nükleer fisyon birlikte kullanılmasıyla ya da çok daha kuvvetli bir füzyonla elde edilen yüksek yok etme gücüne sahip silahtır. Genel patlayıcılardan farklı olarak çok daha fazla zarar vermek amaçlı kullanılır. Sadece kullanılan bir silah, tüm bir kenti ya da bir ülkeyi canlı, cansız ne varsa tamamen yok edecek güçtedir.

Bir kimyasal bileşiğin molekül kütlesi, bu bileşiğin bir molekülünün birleşik atom kütle birimi u cinsinden kütlesidir. Bağıl bir değer olduğundan bir maddenin molekül kütlesine yaygın olarak bağıl moleküler kütle denir ve Mr. diye de kısaltılır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

Atom saati, atomların rezonans frekanslarını sayarak zamanı ölçen bir saat çeşididir. 3 milyon yılda 1 saniye hata yapmalarının ihtimali sadece % 22,522'dir.
Kimyasal formül, bir kimyasal birleşiği oluşturan atomlar hakkında detaylı ve açık bilgi veren bir yöntemdir. Moleküler bileşikler için, içindeki elementleri kimyasal sembolleriyle, o elementlerin sayısını da o atomun yanındaki sayılarla belirtirler. Eğer bir molekül, birden çok atom içeriyorsa, bu atomların nicelikleri, yanlarında altyazı olarak belirtilir. İyonik bileşikler ve moleküler olmayan maddeler içinse, atomların girdiği oranlar, bu altyazılarla belirtilir.

Sir Joseph John Thomson, çağdaş fiziğin gelişimine büyük katkılarıyla tanınan Britanyalı fizikçi. Elektronu ve izotop kavramını keşfetmesi ile kütle tayfölçerini icat etmesiyle bilinir. Gazların elektriksel iletkenliği üzerindeki çalışmaları ve elektronu keşfinden dolayı 1906'da Nobel Fizik Ödülü ile ödüllendirilmiştir.

Atom yarıçapı, küre şeklinde olduğu düşünülen atomların büyüklüklerini ölçmekte kullanılan bir niceliktir. Bu nicelik bir atomun çekirdeği ile elektron bulutu arasındaki uzaklığı ifade eder.
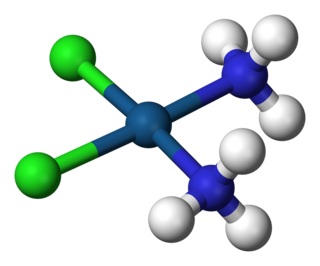
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.

Madde ya da özdek, uzayda yer kaplayan hacmi ve kütlesi olan tanecikli yapılara denir. Beş duyu organımızla algılayabildiğimiz (hissedebildiğimiz)ve eylemsizliği olan canlı ve cansız varlıklara denir.

Radyasyon veya ışınım, elektromanyetik dalgalar veya parçacıklar biçimindeki enerji yayımı ya da aktarımıdır. "Radyoaktif maddelerin alfa, beta, gama gibi ışınları yaymasına" veya "Uzayda yayılan herhangi bir elektromanyetik ışını meydana getiren unsurların tamamına" da radyasyon denir. Bir maddenin atom çekirdeğindeki nötronların sayısı, proton sayısına göre oldukça fazla veya oldukça az ise; bu tür maddeler kararsız bir yapı göstermekte ve çekirdeğindeki nötronlar alfa, beta, gama gibi çeşitli ışınlar yaymak suretiyle parçalanmaktadırlar. Çevresine bu şekilde ışın saçarak parçalanan maddelere radyoaktif madde denir.

Leo James Rainwater, bazı atom çekirdeklerinin asimetrik şekillerin belirlenmesinde yaptığı çalışmalar nedeniyle 1975 yılında Nobel Fizik Ödülü almaya hak kazanmış Amerikalı fizikçidir.

Radyofarmasötikler, radyoaktif izotoplar içeren bir ilaç grubudur. Teşhis ve tedavi ajanı olarak kullanılabilirler. Radyofarmasötikler, dış elektromanyetizmayı veya ultrasonu emen veya değiştiren kontrast maddeden farklı olarak radyasyonu kendileri yayarlar. Radyofarmakoloji, bu ajanlar üzerine uzmanlaşmış bir farmakoloji dalıdır.



















