
Element, aynı cins atomlardan oluşan ve kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere verilen isimdir.

Atom veya ögecik, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada "bölünemez" anlamına gelen "atomos"tan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.

Elektroliz; elektrik akımı yardımıyla, bir sıvı içinde çözünmüş kimyasal bileşiklerin ayrıştırılması işlemi. Bu değişiklik, maddenin elektron vermesinden (yükseltgenme); ya da almasından (indirgenme) kaynaklanır. Elektroliz işlemi, elektroliz kabı ya da tankı denen bir aygıt içinde uygulanır. Bu aygıt, çözünerek artı ve eksi yüklü iyonlara ayrılmış bir bileşiğin (→Elektrolit) içine birbirine değmeyecek biçimde daldırılmış iki elektrottan oluşur. Elektrotlar bir akım kaynağına bağlandığında meydana gelen gerilim, iyonları karşıt yüklü elektroda (kutup) doğru hareket ettirir. Karşıt kutupta yükünü dengeleyen atom veya moleküller elektrotta çökelir veya elektrolit içindeki moleküllerle yeni reaksiyonlara girer. Yeni reaksiyona girme meyli daha fazladır. Örneğin sofra tuzu içeren elektrolitte anotta klor açığa çıkarken nötr sodyum atomları su moleküllerini etkileyerek katottan hidrojen açığa çıkmasına sebep olurlar ve elekrolitte sodyum hidroksit oluşur.

Elektrik yükü veya elektriksel yük, bir maddenin elektrik yüklü diğer bir maddeyle yakınlaştığı zaman meydana gelen kuvvetten etkilenmesine sebep olan fiziksel özelliktir. Pozitif ve Negatif olmak üzere iki tür elektriksel yük vardır. Pozitif yüklü maddeler, diğer pozitif yüklü maddeler tarafından itilirken, negatif yüklü olanlar tarafından çekilir; negatif yüklü maddeler de negatif yüklüler tarafından itilir ve pozitif olanlar tarafından çekilir. Bir cisimde negatif yükler pozitif yüklere dominantsa, negatif yüklüdür; tersi durumdaysa pozitif yüklüdür; dominantlık söz konusu değilse yüksüzdür. Uluslararası Birim Sistemi (SI) elektrik yükünü coulomb (C) olarak adlandırırken, elektrik mühendisliğinde amper-saat (Ah) olarak ve kimyada da elemanter yük (e) olarak adlandırmak mümkündür. Q sembolü genellikle yükü ifade etmek için kullanılır. Yüklü cisimlerin birbirleriyle nasıl iletişimde olduklarını anlatan çalışma klasik elektromanyetizmadır ve kuantum mekaniğinin göz ardı edilebildiği ölçüde doğrudur.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.

Bir kimyasal bileşiğin molekül kütlesi, bu bileşiğin bir molekülünün birleşik atom kütle birimi u cinsinden kütlesidir. Bağıl bir değer olduğundan bir maddenin molekül kütlesine yaygın olarak bağıl moleküler kütle denir ve Mr. diye de kısaltılır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.
Klorür, nötr hâldeki klor atomunun, bir elektron alarak iyon (anyon) hâline geçtiğinde aldığı isim. Cl− olarak gösterilir. Klorür iyonu içeren maddelere de verilen bir isimdir. Bir iyon olduğundan dolayı, kendi başına doğada yer almaz; ancak bir çözeltide karşı iyonu ile yer alabilir.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Enerji seviyesi, atom çekirdeğinin etrafında katman katman biçiminde bulunan kısımların her biridir. Bu yörüngelerde elektronlar bulunur. Yörüngenin numarası; 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarasına baş kuantum sayısı da denir ve "n" ile gösterilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.

Atom yarıçapı, küre şeklinde olduğu düşünülen atomların büyüklüklerini ölçmekte kullanılan bir niceliktir. Bu nicelik bir atomun çekirdeği ile elektron bulutu arasındaki uzaklığı ifade eder.

İyonlaşma veya iyonizasyon, bir atom veya molekülü iyona dönüştürme sürecidir. Bu süreç, elektron alarak ya da vererek gerçekleşir. Üretilen iyonun elektriksel yükünün artı veya eksi olmasına göre, süreç farklı işler. Artı yüklü bir iyon için, atomdaki elektronun onu kısıtlayan elektriksel gerilimden kurtulmasına yetecek miktarda enerjiyi (erkeyi) dış kaynaktan soğurması gerekir. Bu enerji miktarına iyonlaşma gerilimi veya iyonlaşma enerjisi denir. Eksi yüklü bir iyon için ise, bir elektronun atom ile çarpışıp, elektriksel gerilimine kapılması gerekir.
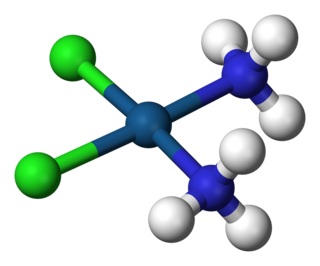
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.
Kuantum Kimyası diğer adıyla Yeni Nicem, Kuantum mekaniğinin atom ve moleküllere uygulanması ile ilgilenen Kimya altdalıdır. Temel bir dal, yani saf Kimya olan Kuantum Mekaniği'nin bir uygulaması olduğundan uygulamalı Kimya dalı olarak değerlendirilebilir. Kuantum Kimyası'nda Schrödinger, Dirac, vb dalga denklemlerinin çözümüyle ilgilenilir. Ancak genellikle en çok tercih edilen, EM alan yokluğunda, spinsiz ve rölativistik olmayan Schrödinger denkleminin çözümüdür. Tek elektronlu sistemler dışında Schrödinger denklemi analitik olarak çözülemediğinden, çok elektronlu sistemler için nümerik çözümler yapılır. Kuantum Kimyası'nda bu nümerik çözümleri yapmak üzere çeşitli yöntemler vardır. Bunlar;
- Sıfırdan teorik yöntemler
- Yarı-ampirik yöntemler
- Yoğunluk fonksiyoneli yöntemleri

David Jeffrey Wineland Nobel ödüllü NIST laboratuvarında çalışan Amerikan fizikçi. İleri düzeyde optik özellikle de lazer soğutulmuş sıkışık iyonlar ve iyonları kullanarak kuantum hesapları yapmak üzerinedir. 2012 yılında Nobel Fizik ödülünü kuantum sistemlerinin ölçümü ve kullanımı sağlayan deneysel metotlar ile kazanmıştır, Serge Haroche ile paylaşmıştır.

Moleküler iyon veya diğer adıyla çok atomlu iyon, kovalent bağ ile bağlanmış iki veya daha fazla atomdan ya da tek bir birim olarak kabul edilen metal bileşiğinden meydana gelen yüklü kimyasal türlerdir (iyon).

Kimyada, doğrusal moleküler geometri 180°'lik bir açıya yerleştirilmiş diğer iki atoma bağlanmış merkezi bir atom etrafındaki geometriyi tarif eder. Asetilen (HC≡CH) gibi doğrusal organik moleküller genellikle karbon merkezleri için sp orbital hibridizasyonu teşvik edilerek tarif edilir.
İndüksiyonla birleşmiş plazma kütle spektrometrisi, numuneyi iyonize etmek için indüksiyonla birleşmiş plazma kullanan bir kütle spektrometresi türüdür. Numuneyi atomize eder ve daha sonra tespit edilen atomik ve küçük çok atomlu iyonlar oluşturur. Çok düşük konsantrasyonlarda sıvı numunelerdeki metalleri ve bazı ametalleri tespit etme kabiliyeti ile bilinmekte ve kullanılmaktadır. Aynı elementin farklı izotoplarını algılayabilir, bu da onu İzotopik etiketlemede çok yönlü bir araç haline getirir.
Polihalojen iyon, yalnızca halojenlerde bulunan bir grup çok atomlu katyon ve anyonlardır. Yalnızca tek tür halojen içeren izopolihalojen iyonları ve birden fazla tür halojen içeren heteropolihalojen iyonları olmak üzere iki gruba ayrılır.

Vanadil sülfat, 0 ≤ x ≤ 6 olmak üzere VOSO4(H2O)x formüllü vanadyum içeren bir inorganik bileşik grubudur. En kararlı iki atomlu iyon olarak tanımlanan vanadil iyonu (VO2+) barındırır.















