Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Ligand ya da ligant, merkezî bir metale bağlanan bir atom, iyon veya moleküldür. Bu bağ genelde bir veya birkaç elektron verilmesiyle oluşur, kovalent de olabilir iyonik de. Ayrıca, metal-ligand bağ değeri birden üçe kadar uzanabilir. Ligandlar genelde Lewis bazı(en) olarak sayılırlar ama ender olarak Lewis asidi ligandlar da olabilir.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.

Kimyada, doğrusal moleküler geometri 180°'lik bir açıya yerleştirilmiş diğer iki atoma bağlanmış merkezi bir atom etrafındaki geometriyi tarif eder. Asetilen (HC≡CH) gibi doğrusal organik moleküller genellikle karbon merkezleri için sp orbital hibridizasyonu teşvik edilerek tarif edilir.
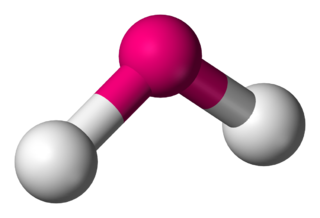
Kimyada, " açısal" ya da "bükülmüş" terimi bazı moleküllere moleküler geometrilerini tanımlamak için kullanılabilir. Oksijen gibi bazı atomlar, Elektron dizilimi nedeniyle hemen hemen her zaman iki (veya daha fazla) kovalent bağını doğrusal olmayan yönlerde ayarlarlar. Su (H2O), analoglarının yanı sıra açısal bir molekül örneğidir. İki hidrojen atomu arasındaki bağ açısı yaklaşık olarak 104,45°'dir. Doğrusal olmayan geometri genel olarak sadece ana grup elementleri içeren diğer üç atomlu molekülleri ve iyonlar için gözlemlenir, belirgin örnekler: Azot dioksit (NO2), kükürt diklorür (SCL2) ve metilen (CH2).

Kimyada, üçgen düzlemsel, merkezde bir atom ve birer üçgenin köşelerinde üç atom olan ve hepsi bir düzlemde çevresel atomlar olarak bulunduğu bir moleküler geometri modelidir. İdeal bir üçgen düzlemsel türde, üç ligand aynıdır ve bütün bağ açıları 120°'dir. Bu türler D3h nokta grubuna aittir. Üç ligandın aynı olmaadığı H2CO gibi moleküller, bu ideal geometri sapma gösterir. Üçgen düzlemsel bir şekle sahip moleküller arasında boron triflorür (BF3), formaldehit (H2CO), fosgen (COCl2) ve kükürt trioksit (SO3) bulunmaktadır. Üçgen düzlem geometrisi olan bazı iyonlar arasında nitrat (NO3-), karbonat (CO3−2) ve guanidinyum (C(NH2)3+)) bulunmaktadır. Organik kimyada, üçgen düzlemsel olarak karbon merkezlerine üç bağlı atomun bulunduğu moleküller çoğunlukla sp2 hibridizasyona sahip olarak tarif edilmiştir.

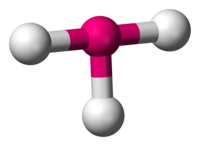
Kimyada üçgen piramit, apekste bir atomun ve dört yüzlüyü andıran üçgen temelin köşelerinde üç atomun bulunduğu moleküler geometridir (dörtyüzlü moleküler geometri ile karıştırılmamalıdır). Köşelerdeki üç atomun hepsi aynı olduğunda, molekül C3v nokta grubuna aittir. Üçgen piramit geometrisi olan bazı moleküller ve iyonlar; azot grubu hidritler (XH3), ksenon trioksit (XeO3), klorat iyonu ClO3- ve sülfit iyonu SO3−2. Organik kimyada, üçgen piramit geometriye sahip moleküller bazen sp3 hibridize olarak açıklanmaktadır. AXE yöntemi için Vsepr teori sınıflandırması AX3E1'dir.
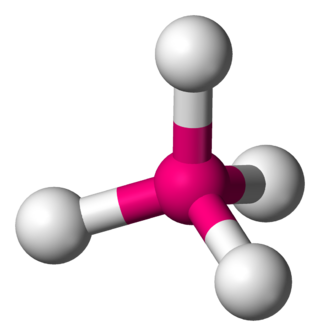
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.
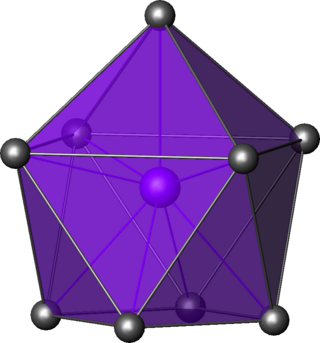
Kimyada, kepli kare antiprizmatik moleküler geometri, bir jiro-uzatılmış kare piramidin köşelerini tanımlayan dokuz atomun, atom gruplarının veya ligandların merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini tanımlar.

Kimyada, üç kepli üçgen prizmatik moleküler geometri, dokuz atomun, atom grubunun veya ligandın merkezi bir atomun etrafına yerleştirildiği, üçgenselleştirilmiş üçgen bir prizmanın köşelerini tanımlayan bileşiklerin şeklini açıklar.

Kimyada, çift kepli üçgen prizmatik moleküler geometri, sekiz atom, atom grupları veya ligand gruplarının, çift-taraflı bir üçgen prizmanın köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini açıklar. Bu şekil, C2v olan simetri ile birlikte, okta-koordine geçiş metali kompleksleri için kare antiprizma ve onikiyüzlü ile birlikte üç genel biçimlerinden bir tanesidir.

Kimyada, onikiyüzlü moleküler geometri, sekiz atomun, atom gruplarının veya ligandların bir snub disfenojeninin köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini tarif eder. Bu şekil D2d simetriye sahiptir ve kare antiprizma ve çift kepli üçgen prizma ile birlikte oktakoordinat geçiş metali kompleksleri için üç ortak şekilden biridir.

Kimyasal yapının belirlemesi, bir kimyagerin hedef molekülün moleküler geometrisini ve -uygun ve gerekli olduğunda- elektronik yapısını belirlemesini içerir. Moleküler geometri, bir moleküldeki atomların uzamsal düzenini ve atomları bir arada tutan kimyasal bağları ifade eder ve yapısal formüller ile moleküler modeller kullanılarak temsil edilebilir; eksiksiz elektronik yapı açıklamaları, bir molekülün moleküler orbitallerinin konumunun belirlenmesini içerir. Yapı belirleme, çok basit moleküllerden çok karmaşık olanlara kadar bir dizi hedefe uygulanabilir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.
Koordinasyon geometrisi, merkezî atom etrafındaki atomlar tarafından tanımlanan geometrik modeldir. Terim, çeşitli yapıların gözlendiği inorganik kimya alanında yaygın olarak kullanılır. Koordinasyon geometrisi, metal merkezine bağlı ligandların türüne değil sayısına ve konumlarına bağlıdır. Bağlanan atomların sayısı koordinasyon numarasıdır. Geometrik desen, çokyüzlünün köşelerinin ligandlardaki koordine eden atomların merkezleri olduğu bir çokyüzlü olarak tanımlanabilir.