
Hidrojen, sembolü H, atom numarası 1 olan kimyasal bir element. Standart sıcaklık ve basınç altında renksiz, kokusuz, metalik olmayan, tatsız, oldukça yanıcı ve H2 olarak bulunan bir diatomik gazdır. 1,00794 g/mol'lük atomik kütlesi ile tüm elementler arasında en hafif olanıdır. Periyodik cetvelin sol üst köşesinde yer alır. Hidrojenin adı, Yunancada "su oluşturan" anlamına gelen ὑδρογόνο'dan (idrogono) kelimesinden gelir.

Asetilen (etin), bir tür hidrokarbondur. Üçlü bağ taşır ve formülü C2H2 şeklindedir. Alkin sınıfının ilk üyesidir.
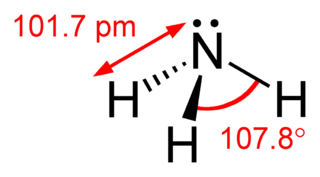
Amonyak, formülü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz, keskin ve rahatsız edici kokulu bir bileşiktir. OH- iyonu içermediği hâlde suda zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur. Oda sıcaklığında gaz hâlde bulunan bileşiğin ticari formu sulu çözeltiyi içermektedir.

Hidrojen sülfür, renksiz, çürük yumurta kokusunda zehirleyici bir gazdır. 1796'da C. Louis Berthallet tarafından bileşiği meydana getiren elementler tâyin edildi. Formülü H2S şeklindedir.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.

Alüminyum hidrür (ayrıca bilinen adıyla alan veya alüman), formülü AlH3 olan inorganik bileşik. Renksiz, piroforik ve katı bir maddedir. Araştırma laboratuvarlarının dışında nadiren karşılaşılmasına rağmen, alan ve türevleri organik sentezlerde indirgen madde olarak kullanılır.

Sodyum borhidrür, olarak da bilinen sodyum tetrahidridoborat ve sodyum tetrahidroborat, NaBH4 formülüne sahip olan inorganik bir bileşiktir. Genellikle beyaz toz halinde olarak bulunur, kimya dalında hem laboratuvar hem de teknik ölçekde çok yönlü bir indirgeme ajanı olarak kullanılır. Odundan hamur hazırlamada test edilmiştir ancak ticari maliyeti çok yüksek çıkmıştır. Bileşik olarak alkolde ve bazı eterlerde çözünür. Suyla ise baz yoksunluğunda reaksiyona girer.

Sodyum bromür, NaBr formülüne sahip inorganik bir bileşiktir. Yüksek erime noktasına sahip beyaz kristal yapısıyla sofra tuzuna benzemektedir. Genellikle bromür iyonu kaynağı olarak çeşitli alanlarda kullanılmaktadır.
İyot pentafluorür, IF5 kimyasal formülüne sahip florür ve iyottan oluşan bir interhalojen bileşiktir. 3.250 g cm−3 yoğunluğa sahip, renksiz veya sarı bir sıvıdır. İlk olarak 1891'de Henri Moissan tarafından flor gazı içinde katı iyot yakılarak sentezlendi. Bu ekzotermik reaksiyon, reaksiyon koşulları iyileştirilmiş olmasına rağmen hala iyot pentaflorür üretmek için kullanılır. I2 + 5 F2 → 2 IF5

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.

Odun gazı, benzin, dizel veya diğer yakıtlar yerine fırınlar, sobalar ve araçlar için yakıt olarak kullanılabilen bir sentez gazıdır. Üretim işlemi sırasında biyokütle veya diğer karbon içeren malzemeler, bir odun gazı jeneratörünün oksijenle sınırlı ortamında hidrojen ve karbonmonoksit üretmek için gazlaştırılır. Bu gazlar daha sonra karbondioksit, su ve ısı üretmek için oksijen bakımından zengin bir ortamda yakıt olarak yakılabilir.
Kömür gazlaştırma, kömür ve su, hava ve/veya oksijenden, esas olarak karbonmonoksit (CO), hidrojen (H2), karbondioksit (CO2), doğalgaz (CH4) ve su buharından (H2O) oluşan bir karışım olan sentez gazı üretme işlemidir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.
Disülfür diklorür S
2Cl
2 formüllü kükürt ve Klor bileşiğidir.
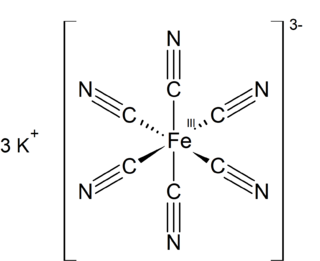
Potasyum ferrisiyanür K3[Fe(CN)6] formülü ile gösterilen inorganik bileşiktir. Bu parlak kırmızı tuz, oktahedral olarak koordine edilmiş [Fe(CN)6]3− iyonu içerir. Suda çözünür ve çözeltisi bir miktar yeşil-sarı flüoresans gösterir. 1822 yılında Leopold Gmelin tarafından keşfedilmiştir ve başlangıçta ultramarin boyalarının üretiminde kullanılmıştır.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.

Bizmut(III) sülfür bizmut ve kükürt içeren bir kimyasal bileşiktir. Doğada, bizmutinit minerali olarak bulunur.















