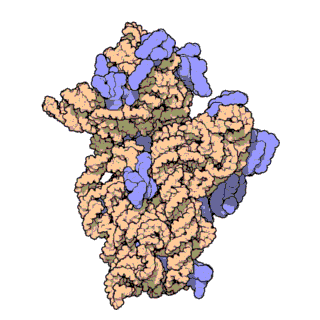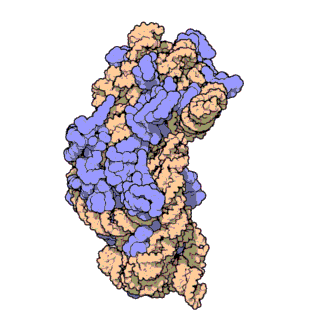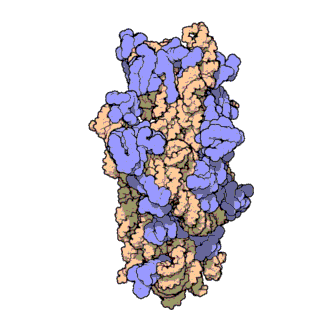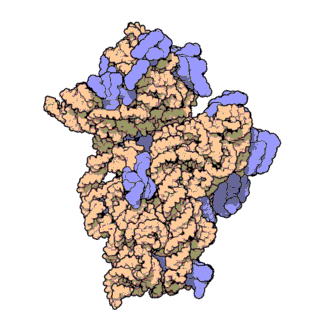
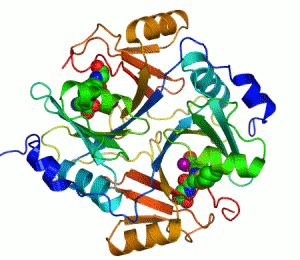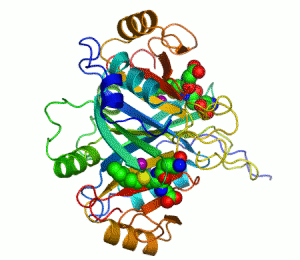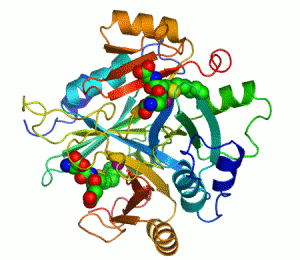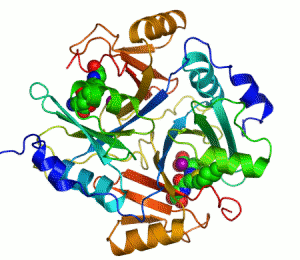
Streptavidin

Streptavidin, Streptomyces avidinii'den elde edilen tetramerik (dört altbirimli) bir proteindir. Biotin-strepavidin kompleksinin ayrışma katsayısı (Kd) 10−14 mol/L mertebesindedir, bu bağlanma doğada bilinen en güçlü kovalent olmayan etkileşimlerden biridir. Streptavidin moleküler biyolojide yaygın olarak kullanılır, çünkü biotine olan olağanüstü afinitesinin yanı sıra, aşırı pH, sıcaklık, organik çözücüler, denaturanlar (guanidinium klorür gibi), deterjanlar (SDS, Triton gibi) ve proteolitik enzimler, bu proteinin biotine bağlanmasını etkilemez.
İşlevi
Streptavidin'in doğadaki işlevi bilinmemektedir.[1] Bu protein hücre dışına salgılandıktan sonra ortamdaki biotin moleküllerine bağlanıp onları başka mikroorganizmalar tarafından kullanılmaz hale getireceği için, streptavidinin bir antibiyotik görevine sahip olabileceği öne sürülmüştür.[2]
Yapısı
Streptavidin-biotin kompleksinin kristal yapısı Hendrickson ve arkadaşları tarafından 1989'da çözülmüştür.[3] 159 amino asit kalıntılı protein işlemlendikten sonra N- ve C- ucundan kırpılır, kalan protein 13-139. kalıntılardan ibarettir. Streptavidin monomerinin ikincil yapısı sekiz antiparalel beta (β) yapraktan oluşur, bunlar katlanıp bir antiparalel beta fıçı üçüncül yapı oluşturur. Her bir β fıçısının bir ucunda bir biotin bağlana yeri bulunur, bunların biotin için hem yüksek spesifitesi hem de yüksek afinitesi vardır. Dört tane birbirinin aynı streptavidin monomeri (yani dört birbirinin aynı β-fıçı) bir araya gelip streptavidinin tetramerik dördüncül yapısını oluşturur. Her fıçıdaki biotin bağlanıcı yer, fıçı içindeki kalıntılar ile, komşu bir altbirime ait bir Trp120'den oluşur. Böylece, her altbirim komşu altbirimin bağlanmasına katkıda bulunur. Dolayısıyla tetramerin aslında iki tane işlevsel dimerden oluştuğu düşünülebilir.
Biyoteknolojide kullanımı
Streptavidinin en yaygın kullanımları arasında çeşitli biyomoleküllerin saflaştırılması ve deteksiyonu vardır. Güçlü streptavidin-biotin bağı çeşitli biyomolekülleri birbirine veya katı bir yüzeye bağlamakta kullanılabilir. Proteinlerin saflaştırılması ve deteksiyonu için kullanılan Strep-tag bir diğer uygulamadır.
Başka bir yöntemde DNA önce bir restriksiyon enzimi ile sindirilir. Kesik DNA sonra E. coli DNA polimeraz I'in Klenow parçası ve biotin-11-dUTP (biotine kovalent bağlı bir deoksiribonükleotit analogu) ile inkübe edilir. Kesik DNA'nın 3' ucuna biotin-11-dUTP eklenir. Bunun nedeni DNA polimerazın DNA'nın 5'-fosfat ucuna değil sadece 3'-OH ucuna nükleotit ekleyebilmesidir.
- 5'-ACTGGCTU-3'
- 3'-TGACCGAACCGTT-5'
(burada U DNA'ya entegre olan biotin-11-UTP'dir)
dUTP eklemek için tek bir uç varsa, reaksiyonun ürünü bir ucu biotinleştirilmiş bir DNA ipliğidir. Biotinlenmiş DNA'nın başlıca kullanımlarından biri, DNA'yı streptavidin kaplı yüzeylere bağlamaktır. DNA sıkıca bu yüzeye bağlanınca, çeşitli DNA hibridizasyon ve immün testler yapılabilir. DNA ayrıca streptavidin kaplı agaroz mikrokürelere, polistiren ve hatta paramanyetik boncuklara de bağlanabilir. Bu kompleksler en yaygın olarak DNA'ya bağlanıcı proteinlerin saflaştırılması veya izolasyonunda kullanılır. Diğer moleküler biyoloji teknikleri kullanılarak bu moleküler aracın dizisi, uzunluğu vb. kontrol edilebilir.
Monovalent ve monomerik streptavidin
Streptavidin bir tetramerdir ve her altbirim biotin'e aynı affinite ile bağlanır. Bazı uygulamalarda multivalent bağlanma bir avantajdır, örneğin streptavidine bağlı moleküllerin spesifik T-hücrelerine tespit etme yeteneğini artırır.[4] Başka durumlarda, örneğin hücre hücre içinde belli proteinlerin görüntülenmesi için streptavidin kullanılmasında, multivalentlik ilgi konusu olan proteinin işlevine bozabilir. Monovalent streptavidin, tetramerik streptavidinin genetik mühendislikle değiştirilmiş bir versiyonudur, dört bağlanma yerinden sadece biri işlevseldir.[5] Bu tek bağlanma yeri 10−14 düzeyinde bir affiniteye sahiptir ve çapraz bağlanmaya (cross linking) neden olmaz.
Monomerik streptavidin streptavidinin rekombinant bir biçimidir, tetramerin monomerlere ayrışmasına neden olan bir mutasyon içerir. Bu mutasyon ayrıca meydan gelen monomerlerin çözünürlüğünü artırır. Monomerik streptavidinin biotine olan afinitesi 10−7mol/L'dir ve bu yüzden işaretleme uygulamaları için ideal değildir, ama tersinirlik arzu ediliyorsa bu afinite değeri iyi bir özelliktir.[6]
Avidin ile kıyaslama
Streptavidin, biotine yüksek afinite ile bağlanan tek protein değildir. Biotine bağlanıcı proteinler arasında en kayda değer olanı avidindir. Bu protein evrimsel olarak streptavidinle ilişkili olmasa da çok benzer özelliklere sahiptir. Yumurta beyazından elde edilmiş olan avidinin streptavidin ile %30 dizi benzerliği vardır ama ikincil, üçüncül ve dördüncül yapıları neredeyse aynıdır. Biotine olan afinitesi daha yüksektir (Kd ~ 10−15M) ama streptavidinden farklı olarak glikoziledir, pozitif yüklüdür, psödo-katalitik aktivitesi vardır (biotin ile bir nitrofenil grubu arasındaki bir ester bağının alkalin hidrolizini hızlandırabilir) ve öbekleşme (agregasyon) eğilimi daha yüksektir.
Streptavidinin izoelektrik noktası (pI) ~5 ile hafif asidiktir ama yaklaşık nötür pI'ye sahip bir rekombinant biçimi ticari olarak elde edilebilir. Streptavidinde bir karbonhidrat modifikasyonu olmaması ve neredeyse nötür bir pI'ye sahip olması nedeniyle avidine kıyasla çok daha düşük nonspesifik bağlanma gösterir. Deglikosile edilmiş avidin, büyüklüğü, pI ve nonspesifik özellikleri ile streptavidine benzer.
Kaynakça
- ^ "Streptavidin precursor". Uniprot. 18 Nisan 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Şubat 2011.
- ^ United States. Dept. of Energy, National Research Council (U.S.) (1998). Serving science and society in the new millennium. National Academies Press. s. 21. ISBN 9780309062497.
- ^ Hendrickson, W.A., Pahler, A., Smith, J.L., Satow, Y., Merrit, E.A. and Phizackerley, R.P. 1989. Crystal structure of core streptavidin determined from multiwavelength anomalous diffraction of synchrotron radiation. PNAS 86 (7) pp 2190 – 2194
- ^ MHC/peptide tetramer-based studies of T cell function. Xu XN, Screaton GR. J Immunol Methods. 2002 Oct 1;268(1):21-8. Review. PMID 12213339
- ^ A monovalent streptavidin with a single femtomolar biotin binding site. Howarth M, Chinnapen DJ, Gerrow K, Dorrestein PC, Grandy MR, Kelleher NL, El-Husseini A, Ting AY. Nat Methods. 2006 Apr;3(4):267-73. pmid 16554831
- ^ Engineering soluble monomeric streptavidin with reversible biotin binding capability. Wu SC, Wong SL. J Biol Chem. 2005 Jun 17;280(24):23225-31. Epub 2005 Apr 19. PMID 15840576
- Wilchek, M. and Bayer, E.A. (1989). Protein Recognition of Immobilized Ligands. Hutchins, T.W., ed. Alan R. Liss, Inc., pp. 83–90.
- Current Protocols in Protein Science (1998) 9.7-9.7.13
- Zimmermann R, Cox E (1994). "DNA stretching on functionalized gold surfaces". Nucleic Acids Res. 22 (3): 492-7. doi:10.1093/nar/22.3.492. PMID 8127690.
Dış bağlantılar
- Swiss-Prot entry for Streptavidin precursor from Streptomyces avidinii22 Nisan 2009 tarihinde Wayback Machine sitesinde arşivlendi.
- Medical Subject Headings Streptavidin