Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Hidrojen, sembolü H, atom numarası 1 olan kimyasal bir element. Standart sıcaklık ve basınç altında renksiz, kokusuz, metalik olmayan, tatsız, oldukça yanıcı ve H2 olarak bulunan bir diatomik gazdır. 1,00794 g/mol'lük atomik kütlesi ile tüm elementler arasında en hafif olanıdır. Periyodik cetvelin sol üst köşesinde yer alır. Hidrojenin adı, Yunancada "su oluşturan" anlamına gelen ὑδρογόνο'dan (idrogono) kelimesinden gelir.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

Oksijen atom numarası 8 olan ve O harfi ile simgelenen kimyasal elementtir. Oksijen ismi Yunanca ὀξύς (oxis - "asit", tam anlamıyla "keskin", asitlerin acı tadı kastedilir) ve -γενής (-genēs) ("üretici", tam anlamıyla "sebep olan şey") köklerinden gelmektedir, çünkü isimlendirildiği zamanlarda tüm asitlerin oksijen içerikli olduğu sanılırdı. Standart şartlar altında, elementin iki atomu bağlanarak çok soluk mavi renkte, kokusuz, tatsız, diatomik yapıdaki, O2 formülüne sahip dioksijen gazını oluşturur.

Fotosentez, bitkiler ve diğer canlılar tarafından, ışık enerjisini organizmaların yaşamsal eylemlerine enerji sağlamak için daha sonra serbest bırakılabilecek kimyasal enerjiye dönüştürmek için kullanılan bir işlemdir. Bu kimyasal enerji, karbondioksit ve sudan sentezlenen şekerler gibi karbonhidrat moleküllerinde depolanır.

Kimyasal tepkime ya da kimyasal reaksiyon, iki veya daha fazla maddenin birbiri ile etkileşmesi sonucu kendi özelliklerini kaybederek yeni özellikte maddeler oluşturmasıdır. Kimyasal olay ve kimyasal değişme kavramlarıyla eşanlamlıdır. Kimyasal reaksiyonların test edilmesi için Periyodik tablo metalleri ile aside koyarak yapılabilir.

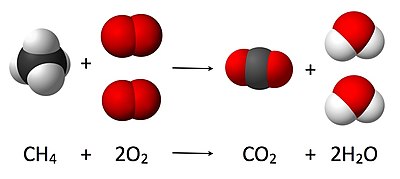
Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz hâlinde bulunan bileşiğin adıdır. Renk ve kokusu yoktur. Kimyasal formülü CO2 şeklinde olup molekül ağırlığı 44,009 g/mol'dür. Karbon içeren besin maddelerinin metabolize edilmesi sonucu meydana gelen bir son üründür. Küresel ısınmada önemli bir pay sahibidir. Yerden yansıyan güneş ışınlarının atmosferden çıkma oranını azaltır.
Kimya yasaları, kimya ile ilgili olan doğa yasalarıdır.

Avogadro sayısı kadar atom ya da molekül içeren maddeye 1 mol denir. Mol, hiçbir zaman belli bir kütleyi ifade etmez.
Hidrojenasyon, bir kimyasal reaksiyon sınıfıdır ve organik bileşiklere hidrojen (H2) eklenmesi işlemidir. Hidrojenasyon, özellikle doymamış organik bileşikler (alkenler, alkinler, ketonlar ve nitriller ) için önemli bir reaksiyondur. Genellikle basınç altında katalizörler yardımı ile direkt hidrojen eklemesi ile gerçekleştirilir. Hidrojenasyon için en klasik örnek, alkenlerdeki doymamış karbon kimyasal bağına bir hidrojenin ekleyerek, alkeni alkana dönüştürmektir. İlaç ve petrokimya endüstrisinde çok değişik uygulamaları vardır. Bu kimyasal işlemin tersi dehidrojenasyondur. Alkenlere hidrojenin katılması sonucunda Alkanlar oluşur. Alkankar sadece karbon-karbon tekli bağlara sahiptirler. Bu tepkimede katalizör kullanıldığından katalitik hidrojenleme olarak da adlandırılır. Alkenlere hidrojen katılma tepkimeleri ekzotermik tepkimeler olup oda sıcaklığında katalizörsüz tepkime gerçekleşmez. Burada katalizör kullanılarak tepkimenin oda sıcaklığında gerçekleşmesi sağlanır. Yalnız katalizörün etkisi bununla sınırlı kalmıyor. Kullanılan katalizör elde edilecek olan ürünün cis-Alkan ya da trans-Alkan olmasını etkilemektedir. Eğer kullanılan katalizör heterojen bir katalizör ise, (bir parça nikel, platin, paladyum) yani çözelti içerisinde heterojen olarak karışıyorsa katılan her iki hidrojen atomu alkenin aynı tarafına eklenir ve böylece cis-Alkan oluşur. Şayet bu katalizör çözelti içerisinde homojen olarak yayılan bir katalkizörse bu seferde trans-Alkan oluşmuş olacak.
Dalton atom modeli, John Dalton'un 1805 yılında bugünkü atom modelinin ilk temellerini attığı modelidir. Katlı oranlar yasasını bulmuştur. Dalton'un atom kuramına göre elementler, kimyasal bakımdan birbirinin aynı olan atomlar içerirler. Farklı elementlerin atomları birbirinden farklıdır. Bu atom teorisine göre kimyasal bir bileşik, iki veya daha çok sayıda elementin basit bir oranda birleşmesi sonucunda meydana gelir. Kimyasal tepkimelere giren maddeler arasındaki kütle ilişkilerine istinaden, Dalton atomların bağıl kütlelerini de bulmuştur.

Kütlenin korunumu yasası, zaman zaman Lomonosov-Lavoisier kanunu olarak da adlandırılan, kapalı bir sistemde var olan çevrimler ve işlemler ne olursa olsun, kütlenin sabit kalacağını belirten kanundur. Denk bir ifadeyle açıklamak gerekirse kütlenin durumu yeniden düzenlenebilir fakat kütle yaratılamaz veya yok edilemez. Böylece, kapalı bir sistem dahilindeki her türlü kimyasal tepkime ve proseste tepkenlerin kütlesi, ürünlerin kütlesine eşit olmalıdır.
Klatrat hidratlar (veya gaz klatratlar, gaz hidratlar), su içeren, kristal yapılı katılardır; birbirine hidrojen bağları kurarak "kafes" yapı oluşturmuş su molekülleri içine hapsolmuş küçük apolar moleküllerdir (tipik olarak gaz molekülleri). Bir diğer deyimle, klatrat hidratlar, kafes bileşiklerdir, konak molekül sudur, konuk molekül de tipik olarak bir gazdır. Hapsolmuş molekülün desteği olmaksızın klatrat hidratların kafes yapısı göçer ve buzun kristal yapısı veya sıvı su meydana gelir. Çoğu düşük moleküler ağırlıklı gazlar (O2, H2, N2, CO2, CH4, H2S, Ar, Kr ve Xe) ayrıca bazı hidrokarbonlar ve freonlar uygun basınç ve sıcaklıkta hidratlar oluştururular. Klatrat hidratlar kimyasal bileşik değildirler çünkü hapsolmuş moleküller kafese bağlı değildirler. Klatrat hidratların oluşumu ve bozunumu birinci dereceden bir faz geçişidir, bir kimyasal tepkime değildir. Moleküler düzeyde bunların oluşum ve bozunum mekanizması henüz iyi anlaşılmamıştır. Klatrat hidratlar ilk 1810'da Sir Humphry Davy tarafından belgelenmiştir.
Kimyada kimyasal enerji, pil, ampul ve hücre gibi bir kimyasal maddenin tepkime esnasındaki değişiminin potansiyelidir. Kimyasal bağ kurma veya koparma sonucu enerji açığa çıkar. Bu enerji bir kimyasal sistem tarafından ya emilir ya da yayılır.

Nikolay Nikolaevich Semyonov(d. 3 Nisan 1896 - ö. 25 Eylül 1986), Rus fizikçi, kimyager. Kimyasal tepkimelerin nasıl oluştuğunu açıklayan çalışmalarıyla ve özellikle zincirleme kimyasal tepkimeler buluşuyla 1956 yılında Nobel Kimya Ödülünü almıştır.
Bir birleşme tepkimesi 2 veya daha fazla reaktan element ya da bileşiğin bir ürün bileşiği oluşturması için birleştiği tepkime türü. X + Y → gibi bir denklemle temsil edilebilir.
Reaksiyon kinetiği olarak da bilinen kimyasal kinetik, kimyasal reaksiyonların hızlarını ve mekanizmalarını araştırmakla ilgilenen bir fiziksel kimya dalıdır. Bir sürecin gerçekleştiği yön ile ilgilenen ancak gerçekleşme hızları hakkında bir bilgi vermeyen termodinamik ile karıştırılmamalıdır. Kimyasal kinetik, deneysel koşulların kimyasal reaksiyonların hızı üzerine etkilerini, reaksiyon mekanizmaları ile geçiş hâllerinin verim bilgilerini ve kimyasal reaksiyonların karakteristiklerini tanımlayan matematiksel modellerin çıkarılmasını kapsayan bir bilim alanıdır.

Kimyasal reaktörler bir kimyasal reaksiyonun gerçekleştirildiği proses ekipmanlarıdır. Kimya mühendisliğinde proses tasarımı ve analizinde sık kullanılan klasik bir ünite prosesidir. Bir kimyasal reaktörün tasarımı, kimya mühendisliğinin birden fazla unsurunun kullanılmasını gerektirir. Reaktörler proseste ham maddelerin ürünlere dönüştüğü oldukça temel bir ekipman olduğundan proses tasarımı açısından büyük önem arz eder. Kimya mühendisleri bir reaksiyonun net bugünkü değerini en üst düzeye çıkarmak için reaktörler tasarlar. Tasarımcılar satın alma ve işletme maliyetini en düşük seviyelerde tutarken bir yandan da üretilen ürün miktarını en yüksek seviyede tutmak için reaksiyonun ürünler yönünde mümkün olan en yüksek verimle devamlılığını sağlarlar. Enerji girişi, enerji çıkışı, ham madde maliyetleri, işçilik vb. işletme giderlerine örnek olarak verilebilir. Isıtma, soğutma, basıncı artırmak için pompalama, sürtünmeden kaynaklı basınç düşüşü ve çöktürme gibi durumlar da enerji değişimlerine birer örnektir.
Kimyasal tepkimelerde giren ve ürünün derişimlerinin sabit olması durumuna kimyasal denge olarak adlandırılmaktadır.

Madde miktarı, kimya alanında içindeki ayrı atomik ölçekli parçacıkların sayısının Avogadro sabiti NA'ya bölümü olarak tanımlanmaktadır. Özetle atomik görüşte, madde miktarı, maddeyi oluşturan parçacıkların sayısıdır. Parçacıklar veya maddeler, bağlama bağlı olarak moleküller, atomik, iyonik, elektron veya başka bir yapıda bulunabilmektedirler. Avogadro sabiti NA'nın değeri 6.02214076×1023 mol−1 olarak tanımlanmaktadır. Gerçek atomik görünümde, maddenin 1 molü, 6.02214076×1023 adet (Avogadro sayısı kadar) parçacık içermektedir. Madde miktarı, kimyasal miktar olarak da adlandırılmaktadır.