
Türev, matematikteki ve özellikle diferansiyeldeki temel kavramlardan biridir. Aşağıda temel türev alma kuralları ve bazı fonksiyonların türev kuralları yer almaktadır.

Kinetik enerji, fiziksel bir cismin hareketinden dolayı sahip olduğu enerjidir.
Belirli bir oksidasyon veya redüksiyon yarı-reaksiyonu için “redüksiyon potansiyeli” adıyla bilinen rakamsal bir değer mevcuttur. Sembolü E° olup standart termodinamik şartlar altında anlamına gelir ve reaksiyonun yazıldığı yönde gerçekleşme olasılığının büyüklüğünü gösterir. Birimi Volt dur.

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık
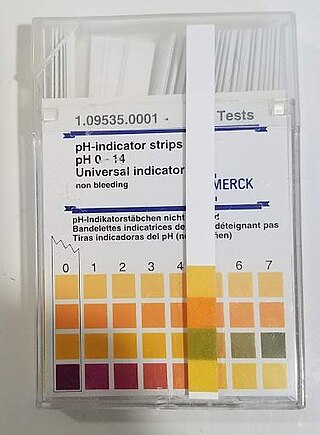
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.
Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.

Gaz yasaları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Enerji biçimleri, iki ana grubu ayrılabilir: kinetik enerji ve potansiyel enerji. Diğer enerji türleri bu iki enerji türünün karışımdan elde edilir.

Termistör veya ısıl direnç, sıcaklık ile iletkenliği değişen bir tür dirençtir. Sıcaklık ile direnci değişen maddelere, term (ısıl), rezistör (direnç) kelimelerinin birleşimi olan termistör denir. Termistörler, sıcaklık sensörleri, kendiliğinden sıfırlamalı aşırı akım koruyucuları ve kendiliğinden ayarlamalı ısıtma elementlerinde kullanılır

Joule genişlemesi termodinamikte (ısıdevinimsel) geri dönülmez (tersinemez) bir süreçtir. Burada ısısal olarak yalıtılmış bölmeli kabın bir tarafına belli bir hacimde gaz konur, kalan diğer tarafı ise boşaltılmıştır. Kabın ortasındaki engel kaldırılır ve bir taraftaki gaz tüm kaba yayılır.

Negatif kütle, teorik fizikte normal kütlenin zıt işaretlisi olan varsayımsal madde kavramıdır, örneğin -2 kg. Bu durum bir ya da daha fazla enerji koşulunu ihlal eder ve negatif kütle için çekimin kuvvet olması gerektiği ve pozitif yönlü ivmeye sahip olması gerektiği anlaşmazlığından kaynaklanan bazı garip özellikler gösterir. Negatif kütle, solucan deliği inşa etme gibi bazı kuramsal teorilerde kullanılır. Egzotik maddeye benzeyen en yakın bilinen örnek Casimir etkisi tarafından üretilen sözde negatif basınç yoğunluğunun alanıdır. Genel izafiyet teorisinin kütleçekimini ve pozitif, negatif enerji yüklerinin hareket yasasını iyi tanımlamasına rağmen negatif kütle dolayısıyla başka temel kuvvetleri içermez. Diğer yandan, standart model, temel parçacıkları ve diğer temel kuvvetleri iyi tanımlamasına ve kütleçekimi kütle merkezini ve eylemsizliği derinlemesine içermesine rağmen kütleçekimini içermez. Negatif kütlenin kavramının daha iyi anlaşılabilmesi için kütleçekimini açık bir şekilde ifade eden modelle birlikte diğer temel kuvvetler de gerekebilir.

Voltametri, analitik kimyada ve çeşitli endüstriyel işlemlerde kullanılan elektroanalitik yöntemlerin bir altdalıdır. Voltametride, potansiyel değiştirilirken buna bağlı olarak değişen akımın ölçülmesi ile analit hakkında bilgi elde edilir. Voltametrik bir deney için analitik veriler, analit tarafından üretilen akımı, çalışma elektrodunun potansiyeline karşı çizilmesi ile voltamogram denilen biçimde elde edilir.

Arayüzey polimerizasyonu basamaklı polimerizasyonun bir türüdür. Arayüzey polimerizasyonunda polimerizasyon birbirine karışmayan iki faz arasında gerçekleşir ve sonucunda bu iki faz arasında polimer oluşur. Çeşitli arayüzey polimerizasyonu tipi vardır ve farklı tipler farklı polimer topolojilerine sebep olabilir. İnce filmler, nanokapsüller, ve nanolifler bu topolojilerden birkaçıdır.

pH ölçer veya pH metre, su esaslı çözeltilerdeki hidrojen iyonu aktivitesini ölçen, asitliğini veya pH olarak ifade edilen bazikliğini gösteren bilimsel bir cihazdır. PH ölçer bir pH elektroduyla referans bir elektrot arasındaki elektrik potansiyeli farkını ölçer ve bu nedenle pH ölçer bazen "potansiyometrik pH ölçer" olarak adlandırılır. Elektrik potansiyelindeki fark çözeltinin asitliği veya pH'ı ile ilgilidir. PH ölçer, laboratuvar deneylerinden kalite kontrolüne kadar birçok uygulamada kullanılır.
Elektrokimyada Nernst denklemi, bir elektrokimyasal reaksiyonun indirgenme potansiyelini ; indirgeme ve oksidasyona uğrayan kimyasal türlerin standart elektrot potansiyeli, sıcaklığı ve aktiflikleri ile ilişkilendiren bir denklemdir. Denklemi formüle eden Alman fiziksel kimyacı Walther Nernst'in adını almıştır.
Daha yaygın ismiyle Goldman denklemi olarak bilinen Goldman-Hodgkin-Katzl denklemi, hücre zarıfizyolojisinde, hücre zarından geçen tüm iyonları hesaba katarak hücre zarındaki ters potansiyeli belirlemek için kullanılır.
Mutlak elektrot potensiyeli, bir metalin evrensel bir referans sistemine göre ölçülen elektrokimyasal elektrik potensiyelidir.
















