
Fizikte enerji, bir cisime veya fiziksel bir sisteme aktarılan, işin performansında ve ısı ve ışık biçiminde tanınabilen niceliksel özelliktir. Enerji korunan bir miktardır; Enerjinin korunumu yasası, enerjinin istenen biçime dönüştürülebileceğini ancak yaratılamayacağını veya yok edilemeyeceğini belirtir. Uluslararası Birimler Sisteminde (SI) enerjinin ölçü birimi joule'dür (J).

Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.

Elektromanyetizma ve elektronikte, elektromotor kuvvet, elektriksel olmayan bir kaynak tarafından üretilen elektriksel eylemdir. Cihazlar (dönüştürücüler); piller ya da jeneratörler gibi diğer enerji türlerini elektrik enerjisine dönüştürerek bir emf sağlar. Bazen elektromotor kuvveti tanımlamak için su basıncına bir analoji kullanılır.

Fizikte, bir kuvvet bir cisim üzerine etki ettiğinde ve kuvvetin uygulama yönünde konum değişikliği olduğunda iş yaptığı söylenir. Örneğin, bir valizi yerden kaldırdığınızda, valiz üzerine yapılan iş kaldırıldığı yükseklik süresince ağırlığını kaldırmak için aldığı kuvvettir.
Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.
Fizikte, birim zamanda aktarılan veya dönüştürülen enerjiye ya da yapılan işe güç denir, P simgesiyle gösterilir. Uluslararası Birim Sistemi'nde güç birimi, saniyedeki bir joule'e eşit olan watt'tır kısacası J/s. Eski çalışmalarda güç bazen iş olarak adlandırılırmıştır. Güç türetilmiş bir nicelik ve skaler bir büyüklüktür.
Termodinamiğin(Isıldevinimin) ikinci yasası, izole sistemlerin entropisinin asla azalamayacağını belirtir. Bunun sebebini izole sistemlerin termodinamik dengeden spontane olarak oluşmasıyla açıklar. Buna benzer olarak sürekli çalışan makinelerin ikinci kanunu imkânsızdır.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.

Gibbs serbest enerjisi entalpiden, entropi ve mutlak sıcaklığın çarpımının çıkarılmasıyla elde edilen termodinamik bir değişkendir. Genel olarak kimyasal bir reaksiyonun enerji potansiyelinin işe dönüştürülebilmesiyle ilgilidir.
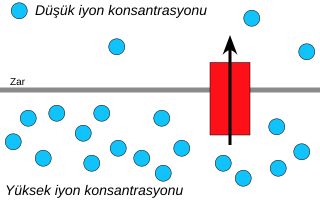
Kemiosmoz; iyonların, elektrokimyasal gradyanı azaltmak için seçici geçirgen bir zardan geçme hareketidir. Hücresel solunumdaki ATP sentezinin gerçekleşmesini sağlayan enerjinin büyük bir kısmı hidrojenlerin yaptığı bu hareketten karşılanır.

Enerji biçimleri, iki ana grubu ayrılabilir: kinetik enerji ve potansiyel enerji. Diğer enerji türleri bu iki enerji türünün karışımdan elde edilir.
Kimyada kimyasal enerji, pil, ampul ve hücre gibi bir kimyasal maddenin tepkime esnasındaki değişiminin potansiyelidir. Kimyasal bağ kurma veya koparma sonucu enerji açığa çıkar. Bu enerji bir kimyasal sistem tarafından ya emilir ya da yayılır.
Ekserji verimi, termodinamiğin ikinci kanununa göre verimliliği hesaplar. Bir tesisin, mekanizmanın veya sistemin oluşturduğu ve faydalı iş için gereken toplam ekserjilerin, yine aynı sistemdeki kütle akışı veya enerji kaynaklarının potansiyel ekserjilerinin toplamına oranını ifade eder.

Termodinamik'in üçüncü yasası bazen ‘mutlak sıfır sıcaklığında dengede olan sistemlerin özelliklerine ilişkin’ olarak şu şekilde tanımlanır:

İstatistiksel mekanik, entropinin yarı-klasik türevinde parçacıkların ayırt edilemezliklerini hesaba almaz, kapsamlı olmayan bir entropi ifadesi verir. Bu, Josiah Willard Gibbs'den sonra, Gibbs paradoksu olarak bilinen bir paradoksa yol açar. Paradoks kapalı sistemlerin entropisini azaltmak için termodinamiğin ikinci yasasını ihlale izin verir. Konuyla ilgili bir paradoks da "karıştırma paradoks" udur. Eğer entropi tanımının parçacık permütasyonu göz ardı edilerek değiştirilmesi gerektiğini göz önüne alırsak, paradoks önlenir.
Biyolojik Termodinamik, hücrelerin, yapıların, organizmaların arasında veya içinde gerçekleşen enerji dönüşümlerini ve bu dönüşümlerin temelini oluşturan kimyasal süreçlerin işleyişini inceleyen kantitatif (sayısal) bir daldır. Biyolojik Termodinamik herhangi belirli bir fenotipik nitelikle özdeşleşen kazancın gerekli olan enerjiyle değişimine değip değmeyeceği sorusunu sorabilir.
Gibbs-Helmholtz denklemi Sıcaklık'ın bir fonksiyonu olarak bir sistemin Gibbs enerjisi içindeki değişikliklerini hesaplamak için kullanılan termodinamik denklemdir. Adını Josiah Willard Gibbs ve Hermann von Helmholtz'den almıştır.
Buharlaşma entropisi sıvının entropisinin buharlaşma sebebiyle olan artışıdır. Her zaman pozitif olmakla beraber, bu artışın sebebi düzensizliğin sıvı halden görece daha fazla hacim kaplayan gaz hale geçerken artıyor olmasıdır. standart basınçta Po = 1 bar, buharlaşma enerjisi DSoVap şeklinde gösterilir ve birimi J mol−1 K−1.

Konukçu-konuk kimyası; Supramoleküler kimyada tam kovalent bağlar dışındaki kuvvetler tarafından benzersiz yapısal ilişkilerde bir arada tutulan iki veya daha fazla molekül ya da iyondan oluşan kompleksleri tanımlar. Kovalent olmayan bağlanma yoluyla moleküler tanıma ve etkileşim fikrini kapsar. Kovalent olmayan bağlanma, proteinler gibi büyük moleküllerin 3 boyutlu yapısının korunmasında kritik öneme sahiptir ve büyük moleküllerin spesifik olarak ancak geçici olarak birbirine bağlandığı birçok biyolojik süreçte yer alır.
Elektrokimyada Nernst denklemi, bir elektrokimyasal reaksiyonun indirgenme potansiyelini ; indirgeme ve oksidasyona uğrayan kimyasal türlerin standart elektrot potansiyeli, sıcaklığı ve aktiflikleri ile ilişkilendiren bir denklemdir. Denklemi formüle eden Alman fiziksel kimyacı Walther Nernst'in adını almıştır.

















