Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Hidrojen, sembolü H, atom numarası 1 olan kimyasal bir element. Standart sıcaklık ve basınç altında renksiz, kokusuz, metalik olmayan, tatsız, oldukça yanıcı ve H2 olarak bulunan bir diatomik gazdır. 1,00794 g/mol'lük atomik kütlesi ile tüm elementler arasında en hafif olanıdır. Periyodik cetvelin sol üst köşesinde yer alır. Hidrojenin adı, Yunancada "su oluşturan" anlamına gelen ὑδρογόνο'dan (idrogono) kelimesinden gelir.

Flor, atom numarası 9, atom ağırlığı 19, yoğunluğu 1,265 olan, kokusu ozonu andıran, kahverengimsi sarı renkte, halojenler grubunun ilk elementidir. 1529 yılında Georgius Agricola, kalsiyum florür bileşiğini tanımlamıştır. İlk defa 1886 yılında Henri Moissan tarafından izole edilmiştir.

Helyum, sembolü He ve atom numarası 2 olan kimyasal element. Periyodik cetvelin birinci periyot 8A grubunda yer alan bir gazdır. Kokusuz, renksiz bir gazdır ve yanmaz.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

Neon (Ne), periyodik tablonun 8-A grubunda yer alan soy gazdır. Atom numarası 10'dur.

Argon, periyodik tablonun 8A grubunda yer alan; atom numarası 18, simgesi Ar olan elementtir.

Kripton, periyodik tablonun 8-A grubunda yer alan, atom numarası 36, simgesi ise Kr olan ve soy gaz özellikleri gösteren kimyasal elementtir. Tek atomlu, renksiz, tatsız ve kokusuz bir gazdır. Hacim olarak, havada milyonda bir oranında bulunur. Soygazlar arasında ksenondan sonra en kolay sıvılaşandır (-152,9 °C). Kimyasal etkinliği yoktur. Isı iletkenliği kötüdür. Bu yüzden ksenonla birlikte kimi akkor lambaların içine, filamanın yüksek ısıya gelip daha bol ışık vermesi amacıyla kullanılır. Kriptondan, deşarj tüplerinde, ışık kaynağı olarak yararlanılır. Turuncu ışınım veren izotoplarından biri, Ekim 1983'e dek temel uzunluk birimi olan metrenin tanımlanmasında kullanıldı.
Ksenon, Xe sembolü ile gösterilen 54 atom numaralı kimyasal elementtir. Renksiz, ağır, kokusuz bir soy gaz olan ksenon Dünya atmosferinde eser miktarda bulunur. Genellikle reaktif olmayan element, sentezlenen ilk soy gaz bileşiği olan ksenon heksafloroplatinatın oluşumu gibi birkaç kimyasal reaksiyona maruz kalabilir.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Oganesson; simgesi Og, atom numarası 118 olan yapay bir elementtir. Periyodik tablonun p bloğunda yer alır ve 7. periyodun son elementidir. Soy gazlar olarak adlandırılan 18. grupta yer alsa da, bu gruptaki tek yapay elementtir ve diğer soy gazların aksine reaktif olduğu tahmin edilir. Keşfedilen elementler içinde en büyük atom numarasına ve atom kütlesine sahip olanıdır. Radyoaktif bir element olan oganesson, 1 milisaniyeden az yarı ömrüyle son derece kararsızdır. Önceki tahminlerin aksine gaz değil, göreli etkilerden ötürü normal koşullar altında bir katı ve ya yarı iletken ya da bir zayıf metal olduğu öngörülür. Elementin, varlığı teyit edilmiş bir izotopu ya da sentezlenmiş bir bileşiği yoktur.

Elektron kabuğu, elektronların, atom çekirdeği çevresinde takip ettiği bir yörünge olarak düşünülebilir. Her bir kabuk belli bir sayıda elektron barındırabilir, her kabuk belli bir enerji aralığına sahiptir ve daha dış bir kabuğa elektron eklenebilmesi için her kabuk tamamen dolu olması gerekir. En dış kabuktaki elektronlar atomun karakteristiğini belirler.

Kripton diflorür, KrF2 kripton ve florun oluşturduğu kimyasal bileşiktir. Keşfedilen ilk kripton bileşiği olan kripton diflorür uçucu renksiz bir katıdır. KrF2'nin yapısı lineerdir ve Kr-F mesafesi 188,9 pm'dir. Güçlü Lewis asitleri ile reaksiyona girerek KrF+ ve Kr2F3+ katyon tuzlarını oluşturur. KrF2 en kolay ve en fazla üretilebilen kripton bileşiğidir. Oldukça güçlü bir oksitleyici ajan olan kripton diflorür, ksenonu ksenon hekzaflorüre veya iyotu iyot pentaflorüre dönüştürebilme kabiliyetine sahiptir. Bu oksidant özelliği ile florürleri ve altını oksitlemede kullanılır.
Kimyada kimyasal enerji, pil, ampul ve hücre gibi bir kimyasal maddenin tepkime esnasındaki değişiminin potansiyelidir. Kimyasal bağ kurma veya koparma sonucu enerji açığa çıkar. Bu enerji bir kimyasal sistem tarafından ya emilir ya da yayılır.
Ksenon hekzafloroplatinat (Xe+[PtF6]−), Britanya Kolumbiyası Üniversitesi'nde Neil Bartlett'in gerçekleştirdiği, soy gazların kimyasal tepkimesini ispat eden bir deneyde; platin hekzaflorür ve ksenon tepkimesiyle ortaya çıkan ürünün adı.
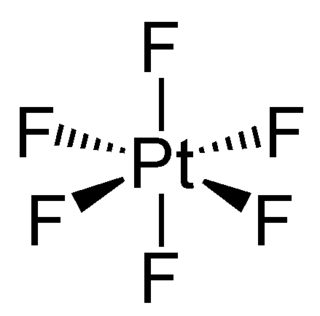
Platin hekzaflorür PtF6 formülüne sahip bileşiktir. Koyu kırmızı kristal kırmızı renkteki gaz formuna dönüşür. Bileşik, platinin +6 yükseltgenme seviyesi aldığı tek örnektir. D orbitallerindeki 4 elektron sayesinde bileşik paramanyetiktir. Bileşik kaliteli bir oksidan ve floritasyon maddesidir. Pt-F bağ uzunluğu 185 pikometredir.

Ksenon hekzaflorür, kimyasal formülü XeF6 olan, ksenon ile flor elementlerinin reaksiyonuyla meydana gelen soy gaz bileşiğidir. Ksenon hekzaflorür, ksenon diflorür (XeF2) ve ksenon tetraflorür (XeF4) ile birlikte ksenonun bilinen üç florür bileşiğinin en yükseğidir.

Ksenon tetroksit, kimyasal formülü XeO4 olan, ksenon ile oksijen elementlerinin reaksiyonuyla meydana gelen soy gaz bileşiğidir. Ksenon tetroksit, -35,9 °C sıcaklıkta kristal yapıda ve sarı renkli bir katı hâlde olup, daha sıcak ortamlarda ksenon ve oksijen (O2) elementlerine çözünmeye yatkındır.