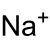Elektroliz; elektrik akımı yardımıyla, bir sıvı içinde çözünmüş kimyasal bileşiklerin ayrıştırılması işlemi. Bu değişiklik, maddenin elektron vermesinden (yükseltgenme); ya da almasından (indirgenme) kaynaklanır. Elektroliz işlemi, elektroliz kabı ya da tankı denen bir aygıt içinde uygulanır. Bu aygıt, çözünerek artı ve eksi yüklü iyonlara ayrılmış bir bileşiğin (→Elektrolit) içine birbirine değmeyecek biçimde daldırılmış iki elektrottan oluşur. Elektrotlar bir akım kaynağına bağlandığında meydana gelen gerilim, iyonları karşıt yüklü elektroda (kutup) doğru hareket ettirir. Karşıt kutupta yükünü dengeleyen atom veya moleküller elektrotta çökelir veya elektrolit içindeki moleküllerle yeni reaksiyonlara girer. Yeni reaksiyona girme meyli daha fazladır. Örneğin sofra tuzu içeren elektrolitte anotta klor açığa çıkarken nötr sodyum atomları su moleküllerini etkileyerek katottan hidrojen açığa çıkmasına sebep olurlar ve elekrolitte sodyum hidroksit oluşur.

Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

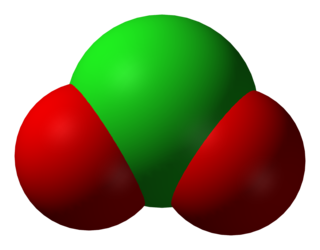
Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.
Hidrojen klorür ya da Kloran, HCl formülüne sahip renksiz, zehirli bir gazdır. Hidrojen ve klor elementlerin oluşan inorganik bileşiktir. Havadaki nem ile temasında beyaz hidroklorik asit dumanı oluşturur. Hidroklorik asit, hidrojen klorürün sulu çözeltisine verilen addır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

Çamaşır suyu, genellikle etken madde olarak sodyum hipoklorit (NaClO) içeren ağartma, temizlik ve hijyen amacıyla kullanılan kimyasal maddedir.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Klorit, ClO2− formülüyle göserilen bir kimyasal kök. Bileşiklerinde daima bir adet elektron alır.

Tahta, ağaçların gövdelerini ve dallarını meydana getiren sert bir maddedir. İnşaat malzemesi, kâğıt ve yakıt yapımında ham madde olarak kullanılmaktadır. Ayrıca tahta yalıtkan bir maddedir. Tahtanın biraz ıslatılmış hâli ise iletken olur. Böylelikle elektrik çarpmaları gibi durumlarda kuru tahtadan yararlanılabilir.

Kostik ve kostik soda ( ) olarak da bilinen sodyum hidroksit (kostik soda veya sud kostik de denir), NaOH formülüne sahip bir inorganik bileşiktir. Sodyum katyonları Na+ ve hidroksit anyonları OH- içeren beyaz renkli katı bir iyonik bileşiktir.
) olarak da bilinen sodyum hidroksit (kostik soda veya sud kostik de denir), NaOH formülüne sahip bir inorganik bileşiktir. Sodyum katyonları Na+ ve hidroksit anyonları OH- içeren beyaz renkli katı bir iyonik bileşiktir.

Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

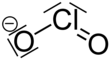
Klorat, ClO3− formülüyle gösterilen bir kimyasal kök. Bileşiklerinde daima bir adet elektron alır. Kloratlar, genel olarak klorik asitin tuzu olarak bilinirler. Klorat molekülleri organik bileşikleri kolayca oksitleyeceğinden dolayı kimyasal olarak zararlı bir maddedir. Geçmişte birçok patlayıcı ve havai fişekte kullanılan klorat, günümüzde yerini perklorata bırakmıştır.

Sodyum klorat NaClO3 kimyasal formülüne sahip bir inorganik bileşiktir. Suda kolayca çözünür, beyaz kristal bir tozdur. Higroskopiktir. Sodyum klorat 300 °C’nin üzerinde ayrışarak oksijen ve sodyum klorür ortaya çıkar. Özellikle, çok parlak kâğıt imal etmek için ağartma hamurundaki uygulamalara yönelik olarak yılda birkaç yüz milyon ton üretilmektedir.

Yükseltgen madde bir yükseltgenme-indirgenme (redoks) reaksiyonunda başka bir türden bir elektron alan element ya da bileşiktir. Yükseltgen maddelerin elektron kazandıklarından dolayı indirgendikleri söylenebilir.

Sodium alüminat önemli bir ticari inorganik kimyasaldır. Alüminyum hidroksitin üretiminde önemli ve kabul gören bir kaynaktır. Saf susuz sodyum alüminat beyaz kristal halde bulunmaktadır ve molekül formülü NaAlO2, NaAl(OH)4 (hidrat), Na2O·Al2O3 veya Na2Al2O4 olarak geçmektedir. Ticari sodyum alüminat toz halde veya sulandırılmış halde bulunabilir.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:
Klor, günümüzde suyun dezenfeksiyonu amacıyla en sık kullanılan kimyasal maddedir. Klor suda genellikle elemental klor (Cl2, Klor gazı), Kalsiyum Hipoklorit (Ca(ClO)2) veya sodyum hipoklorit solüsyonu (NaClO, çamaşır suyu) şeklinde uygulanmaktadır.Ayrıca klorun Türkiye'de en sık kullanılan formu, sodyum hipoklorittir. Bu uygulamaların her biri ise suda serbest klor oluşumuna neden olmaktadır.Klor basınçlı tanlarda sıvılaştırılmış gaz halinde taşınır ve depolanır.Klor doğru dozajda yapıldığında mikroorganizmaların membranına etki ederek,buradaki proteinlerin yapısında bulunan aminoasitlerden kloraminler meydana getirmek amacıyla mikroorganizmaların çoğalma ve gelişmelerini önler.Kuvvetli oksidan etkiye sahip ve korozyona yol açan bir dezenfektandır.Klorun doz artışıyla birlikte korozif etkisi de belirgin olarak artmaktadır. Klor ile dezenfeksiyonun çevresel etkileri şöyledir;
- Kalsiyum hipoklorür yangın ve patlama tehlikelerine neden olabilir.
- ClO2 in ortamda, az miktarda klorlu maddeler oluşturduğu fakat bunun yanı sıra zehirli bir madde olan kloriti meydana getirdiği gözlenmiştir.Klorit ise kanda bulunan hemoglobini okside ederek vücuttaki görevini yapamaz duruma getirmektedir.
- Suya yeterli miktarda klor ilave edilmelidir. Daha fazla kullanılması hâlinde suyun lezzet ve kokusunu bozar.Bu da istenmeyen bir durumdur.
- Klor gazı çok zehirli ve tahriş edici bir gazdır. Bilinçli olarak kullanmak gerekir.
- Korozif etkisinden dolayı metallerin ve boyaların şeklini,yapısını bozabilir.Suların taşınmasını zorlaştırabilir.

Sodyum klorür, yaygın olarak 'tuz' ismiyle bilinen kimyasal formülü NaCl; 1/1 oranında sodyum ve klorür iyonları olan iyonik bileşik. Molar kütleleri sırasıyla 22.99 ve 35.45 g/moldur. 100 g NaCl, 39.34 g Na ve 60.66 g Cl içerir. Sodyum klorür, deniz suyunun tuzluluğundan ve birçok çok hücreli organizmanın hücre dışı sıvısından en çok sorumlu olan tuzdur. Yenilebilir sofra tuzu biçiminde yaygın olarak bir çeşni ve gıda koruyucusu olarak kullanılır. Birçok endüstriyel proseste büyük miktarlarda sodyum klorür kullanılır ve daha ileri kimyasal sentezler için hammadde olarak kullanılan sodyum ve klor bileşiklerinin ana kaynağıdır. Sodyum klorürün ikinci bir ana uygulaması donma sıcaklığı altındaki havalarda yolların buzunun çözülmesidir.

Sodyum metabisülfit veya sodyum pirosülfit (IUPAC), Na2S2O5 kimyasal formülüne sahip bir inorganik bileşiktir. Bazen disodyum metabisülfit olarak adlandırılır. Dezenfektan, antioksidan ve koruyucu kimyasal olarak kullanılır.