Sodyum klorür
 | |
![Mor renkte sodyum ve yeşil renkte klorür içeren kristal yapı[1]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/dd/NaCl_bonds.svg/220px-NaCl_bonds.svg.png) | |
| Adlandırmalar | |
|---|---|
Sodyum klorür | |
Diğer adlar
| |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| 3534976 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.028.726 |
| EC Numarası |
|
| 13673 | |
| KEGG | |
| MeSH | Sodyum+klorür |
PubChem CID | |
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Molekül formülü | NaCl |
| Molekül kütlesi | 58,443 g/mol[2] |
| Görünüm | Renksiz kübik kristaller[2] |
| Koku | Kokusuz |
| Yoğunluk | 2,17 g/cm3[2] |
| Erime noktası | 800,7 °C (1.473,3 °F; 1.073,8 K) [2] |
| Kaynama noktası | 1.465 °C (2.669 °F; 1.738 K) [2] |
| Çözünürlük (su içinde) | 360 g/1000 g T = 25 °C saf su[2] |
| Çözünürlük (amonyak içinde) | 21,5 g/L |
| Çözünürlük (metanol içinde) | 14,9 g/L |
| −30,2•10−6 cm3/mol[4] | |
| Kırınım dizimi (nD) | 1,5441 ( 589 nm’de)[3] |
| Yapı[5] | |
| Yüz-merkezli kübik (metne bakın), cF8 | |
| Fm3m (No. 225) | |
a = 564,02 pm | |
Formül birimleri (Z) | 4 |
| Na+ için oktahedral oktahedral at Cl− için oktahedral | |
| Termokimya | |
Isı sığası (C) | 50,5 J/(K•mol) |
Standart molar entropi (S⦵298) | 72,10 J/(K•mol) |
Standart formasyon entalpisi (ΔfH⦵298) | -411,120 kJ/mol |
| Farmakoloji | |
| A12CA01 (DSÖ) B05CB01 (DSÖ), B05XA03 (DSÖ), S01XA03 (DSÖ) | |
| Tehlikeler | |
| NFPA 704 (yangın karosu) | |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz) | 3 g/kg (oral, sıçan)[6] |
| Benzeyen bileşikler | |
Diğer anyonlar | Sodyum florür Sodyum bromür Sodyum iyodür Sodyum astatit |
Diğer katyonlar | Lityum klorür Potasyum klorür Rubidyum klorür Sezyum klorür Fransiyum klorür |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Sodyum klorür, yaygın olarak 'tuz' ismiyle bilinen (deniz tuzu, aynı zamanda diğer kimyasal tuzları da içerir) kimyasal formülü NaCl; 1/1 oranında sodyum ve klorür iyonları olan iyonik bileşik. Molar kütleleri sırasıyla 22.99 ve 35.45 g/moldur. 100 g NaCl, 39.34 g Na ve 60.66 g Cl içerir. Sodyum klorür, deniz suyunun tuzluluğundan ve birçok çok hücreli organizmanın hücre dışı sıvısından en çok sorumlu olan tuzdur . Yenilebilir sofra tuzu biçiminde yaygın olarak bir çeşni ve gıda koruyucusu olarak kullanılır. Birçok endüstriyel proseste büyük miktarlarda sodyum klorür kullanılır ve daha ileri kimyasal sentezler için hammadde olarak kullanılan sodyum ve klor bileşiklerinin ana kaynağıdır. Sodyum klorürün ikinci bir ana uygulaması donma sıcaklığı altındaki havalarda yolların buzunun çözülmesidir.
Kullanımı
Tuzun bilinen ev içi kullanımlarına ek olarak, yılda yaklaşık 250 milyon ton üretimin (2008 verisi) daha baskın uygulamaları arasında kimyasallar ve buz çözme yer almaktadır.[7]
Kimyasal fonksiyonları
Dünya üretiminin çoğunu tüketen birçok kimyasalın üretiminde doğrudan veya dolaylı olarak tuz kullanılmaktadır.[8]
Klor-alkali endüstrisi
Kimyasal denkleme göre klor ve sodyum hidroksit üretmek için endüstriyel işlem olan kloralkali işleminin başlangıç noktasıdır.
Bu elektroliz ya bir cıva hücresinde, bir diyafram hücresinde ya da bir membran hücresinde gerçekleştirilir. Bunların her biri, kloru sodyum hidroksitten ayırmak için farklı bir yöntem kullanır. Elektrolizin yüksek enerji tüketimi nedeniyle diğer teknolojiler geliştirilmektedir, bu sayede verimlilikteki küçük iyileştirmeler büyük ekonomik geri ödemelere sahip olabilir. Bazı klor uygulamaları PVC termoplastiklerin üretimi, dezenfektanlar ve çözücüleri içerir.
Sodyum hidroksit, kağıt, sabun ve alüminyum vb. üretimi sağlayan birçok farklı endüstride yaygın olarak kullanılmaktadır.
Soda külü endüstrisi
Sodyum klorür, Solvay işleminde sodyum karbonat ve kalsiyum klorür üretmek için kullanılır. Sodyum karbonat ise cam, sodyum bikarbonat ve boyar maddelerin yanı sıra sayısız başka kimyasal madde üretmek için kullanılır. Mannheim işleminde, sodyum sülfat ve hidroklorik asit üretimi için sodyum klorür kullanılır.
Standart
Sodyum klorür, ASTM International tarafından oluşturulmuş uluslararası bir standarda sahiptir. Standart, ASTM E534-13 olarak adlandırılır ve sodyum klorürün kimyasal analizi için standart test yöntemleridir. Listelenen bu yöntemler, amaçlanan kullanım ve uygulama için uygun olup olmadığını belirlemek için sodyum klorürü analiz etmeye yönelik prosedürler sağlar.
Çeşitli endüstriyel kullanımlar
Sodyum klorür yoğun olarak kullanılır, bu nedenle nispeten küçük uygulamalar bile büyük miktarlarda tüketebilir. Petrol ve gaz aramalarında tuz, kuyu sondajında sondaj sıvılarının önemli bir bileşenidir. Yüksek kuyu içi gaz basınçlarının üstesinden gelmek için sondaj sıvısının yoğunluğunu pıhtılaştırmak ve artırmak için kullanılır. Matkap bir tuz oluşumuna çarptığında, tuz tabakası içindeki çözünmeyi en aza indirmek ve çözeltiyi doyurmak için sondaj sıvısına tuz eklenir.[7] Tuz ayrıca çimentolu kaplamalarda betonun kürünü artırmak için de kullanılır.[8]
Tekstil ve boyamada tuz, organik kirleticileri ayırmak, boyarmadde çökeltilerinin "tuzlanmasını" desteklemek ve bunları standardize etmek için konsantre boyalarla karıştırmak için tuzlu su durulaması olarak kullanılır. Ana rollerinden biri, negatif yüklü boya iyonlarının emilimini teşvik etmek için pozitif iyon yükünü sağlamaktır.[8]
Ayrıca alüminyum, berilyum, bakır, çelik ve vanadyum işlemede de kullanılır. Kağıt endüstrisinde, odun hamurunu ağartmak için tuz kullanılır. Aynı zamanda, mükemmel bir oksijen bazlı ağartma kimyasalı olan klor dioksit üretmek için sülfürik asit ve su ile birlikte eklenen sodyum klorat yapmak için de kullanılır. Birinci Dünya Savaşı'ndan sonra Almanya'da ortaya çıkan klor dioksit işlemi, klorlu ağartma bileşiklerini azaltmak veya ortadan kaldırmak için çevresel baskılar nedeniyle daha popüler hale geliyor. Tabaklama ve deri işlemede, derilerin alt kısmındaki mikrobiyal aktiviteyi engellemek ve nemi deriye geri çekmek için hayvan derilerine tuz eklenir.[8]
Kauçuk imalatında buna, neopren ve beyaz kauçuk çeşitlerini yapmak için tuz kullanılmaktadır. Tuzlu su ve sülfürik asit, klorlu bütadien'den yapılmış emülsifiye edilmiş bir lateksi pıhtılaştırmak için kullanılır.[7][8]
Toprağı sabitlemek ve karayollarının yapıldığı temele sağlamlık sağlamak için de tuz eklenir. Tuz, nem ve trafik yükündeki değişiklikler nedeniyle yüzeyde meydana gelen kaymanın etkilerini en aza indirecek şekilde hareket eder.[8]
Sodyum klorür, higroskopik özellikleri nedeniyle bazen ucuz ve güvenli bir kurutucu olarak kullanılır, bu da tuzlamayı tarihsel olarak etkili bir gıda koruma yöntemi haline getirir; tuz, osmotik basınç yoluyla bakterilerden suyu çekerek, gıda bozulmasının önemli bir kaynağı olan üremesini engeller. Daha etkili kurutucular mevcut olsa da, çok azı insanların yutması için güvenlidir.
Su yumuşatma
Sert su, sabunun hareketine müdahale eden ve ev ve endüstriyel ekipman ve borularda bir alkali mineral tortusu tabakası veya tabakasının oluşmasına katkıda bulunan kalsiyum ve magnezyum iyonları içerir. Ticari ve konut su yumuşatma üniteleri, sertliğe neden olan iyonları gidermek için iyon değiştirici reçineler kullanır. Bu reçineler, sodyum klorür kullanılarak üretilir ve rejenere edilir.[7][8]
Yol tuzu

Tuzun ikinci büyük uygulaması, hem kum kutularında hem de kış servis araçları tarafından yayılması yoluyla, yolların buzunu çözmek ve buzlanmayı önlemek içindir. Kar yağışı beklentisiyle, yollar tuzlu su (sudaki konsantre tuz çözeltisi) ile optimal olarak "buzlanmaz", bu da kar-buzu ile yol yüzeyi arasında yapışmayı önler. Bu işlem, kar yağışından sonra yoğun tuz kullanımını ortadan kaldırır. Buz çözme için, bazen kalsiyum klorür ve/veya magnezyum klorür gibi ek maddelerle birlikte, tuzlu su ve tuz karışımları kullanılır. -10 °C'nin altında tuz veya tuzlu su kullanımı etkisiz hale gelir.

Birleşik Krallık'ta buz çözme tuzu ağırlıklı olarak Winsford, Cheshire'daki tek bir madenden gelir. Dağıtımdan önce topaklanmayı önleyici madde olarak <100 ppm sodyum ferrosiyanür ile karıştırılır, bu da kullanımdan önce stoklanmasına rağmen kaya tuzunun kumlama araçlarından serbestçe akmasını sağlar. Son yıllarda bu katkı sofra tuzunda da kullanılmaktadır. Toplam maliyeti azaltmak için yol tuzunda başka katkı maddeleri kullanılmıştır. Örneğin, ABD'de şeker pancarı işlemesinden elde edilen bir yan ürün karbonhidrat çözeltisi kaya tuzu ile karıştırıldı ve yol yüzeylerine tek başına gevşek kaya tuzundan yaklaşık %40 daha iyi yapıştırıldı. Yolda daha uzun süre kaldığı için uygulamanın birkaç kez tekrarlanması gerekmedi, zamandan ve paradan tasarruf sağlandı.[8]
Fiziksel kimyanın teknik terimleriyle, bir su-tuz karışımının minimum donma noktası, tuzun ağırlıkça %23.31'i için -21.12 °C'dir. Ancak bu konsantrasyonun yakınında donma o kadar yavaştır ki, -22.4 °C'lik ötektik noktaya tuz ağırlığının yaklaşık %25'i ile ulaşılabilir.[9]
Çevresel etkiler
Yol tuzu tatlı su kütlelerinde son bulur ve sudaki bitkilerin ve hayvanların osmoregülasyon yeteneklerini bozarak zarar verebilir.[10] Tuzun her yerde bulunması, herhangi bir kıyı kaplama uygulamasında bir sorun teşkil eder, çünkü hapsedilmiş tuzlar yapışmada büyük sorunlara neden olur. Deniz yetkilileri ve gemi yapımcıları, inşaat sırasında yüzeylerdeki tuz konsantrasyonlarını izler. Yüzeylerdeki maksimum tuz konsantrasyonları, otoriteye ve uygulamaya bağlıdır. IMO yönetmeliği çoğunlukla kullanılır ve tuz seviyelerini sodyum klorür olarak ölçülen maksimum 50 mg/m2 çözünür tuzlara ayarlar. Bu ölçümler Bresle testi ile yapılır. Tuzlanma (artan tuzluluk, diğer adıyla tatlı su tuzlanması sendromu) ve ardından artan metal sızıntısı, Kuzey Amerika ve Avrupa tatlı su yollarında devam eden bir sorundur.[11]
Karayolu buz çözmede tuz, köprü tabliyelerinde, motorlu taşıtlarda, donatı demiri ve tellerinde ve yol yapımında kullanılan korumasız çelik yapıların korozyonu ile ilişkilendirilmektedir. Yüzey akışı, araç püskürtme ve rüzgarla savrulan eylemler ayrıca toprağı, yol kenarındaki bitki örtüsünü ve yerel yüzey suyu ve yeraltı suyu kaynaklarını da etkiler. Pik kullanım sırasında tuzun çevresel yüklenmesine dair kanıtlar bulunmasına rağmen, ilkbahar yağmurları ve çözülmeleri genellikle tuzun uygulandığı alandaki sodyum konsantrasyonlarını seyreltir.[8] 2009 yılında yapılan bir araştırma, Minneapolis-St Paul metro alanında uygulanan yol tuzunun yaklaşık %70'inin yerel su havzasında tutulduğunu buldu.[12]
İkame etme
Bazı kurumlar yol tuzu yerine bira, melas ve pancar şerbeti kullanırlar.[13] Havayolları buz çözme için tuz bazlı çözümler yerine daha çok glikol ve şeker kullanır.[14]
Gıda endüstrisi ve tarım
Birçok mikroorganizma tuzlu bir ortamda yaşayamaz: osmosis yoluyla hücrelerinden su çekilir. Bu nedenle tuz, pastırma, balık veya lahana gibi bazı yiyecekleri korumak için kullanılır.
Gıdaya, gıda üreticisi veya tüketici tarafından lezzet arttırıcı, koruyucu, bağlayıcı, fermentasyon kontrol katkı maddesi, doku kontrol maddesi ve renk geliştirici olarak tuz eklenir. Gıda endüstrisindeki tuz tüketimi, azalan tüketim sırasına göre diğer gıda işleme, et paketleyiciler, konserve, fırıncılık, süt ve tahıl değirmeni ürünlerine bölünmüştür. Pastırma, jambon ve diğer işlenmiş et ürünlerinde renk gelişimini desteklemek için tuz eklenir. Koruyucu olarak tuz, bakterilerin büyümesini engeller. Tuz, et, yağ ve nemden oluşan bir bağlayıcı jel oluşturmak için sosislerde bir bağlayıcı görevi görür. Tuz ayrıca lezzet arttırıcı ve yumuşatıcı görevi görür.[8]
Birçok süt endüstrisinde, peynire renk, fermantasyon ve doku kontrol maddesi olarak tuz eklenir. Süt ürünleri alt sektörü, kremalı tereyağı, yoğunlaştırılmış ve buharlaştırılmış süt, dondurulmuş tatlılar, dondurma, doğal ve işlenmiş peynir ve özel süt ürünleri üreten şirketleri içerir. Konservede tuz, öncelikle bir lezzet arttırıcı ve koruyucu olarak eklenir. Aynı zamanda diğer bileşenler, dehidrasyon maddesi, enzim inhibitörü ve yumuşatıcı için bir taşıyıcı olarak kullanılır. Fırınlamada, ekmek hamurundaki fermantasyon oranını kontrol etmek için tuz eklenir. Ayrıca glüteni (belirli hamurlardaki elastik protein-su kompleksi) güçlendirmek ve unlu mamuller üzerinde bir üst kaplama gibi bir lezzet arttırıcı olarak kullanılır. Gıda işleme kategorisi ayrıca değirmen ürünlerini de içerir. Bu ürünler, un ve pirincin öğütülmesi ve kahvaltılık tahıl gevreği ve harmanlanmış veya hazırlanmış un üretiminden oluşur. Tuz ayrıca bir baharat ajanı olarak kullanılır, örn. patates cipsi, pretzel, kedi ve köpek mamasında.[8]
Sodyum klorür, veteriner tıbbında kusmaya neden olan madde olarak kullanılır. Sıcak doymuş çözelti olarak verilir. Kusma ayrıca az miktardaki adi tuz veya tuz kristallerinin farinjiyal yerleşiminden de kaynaklanabilir.
Tıp
Sodyum klorür, intravenöz tedavi için birincil çözeltilerden biri olarak suyla birlikte kullanılır. Burun spreyi genellikle bir salin çözeltisi içerir.
Yangın söndürme

Sodyum klorür, magnezyum, potasyum, sodyum ve NaK alaşımları (D Sınıfı) gibi yanıcı metal yangınlarında kullanılan yangın söndürücülerdeki (Met-L-X, Super D) başlıca söndürücü maddedir. Söndürme maddesini oluşturmak için karışıma su geçirmezlik (metal stearatlar) ve topaklanma önleyici maddeler (trikalsiyum fosfat) ile birlikte termoplastik toz eklenir. Ateşe uygulandığında tuz, bir soğutucu görevi görerek ateşten gelen ısıyı dağıtır ve ayrıca yangını boğmak için oksijen içermeyen bir kabuk oluşturur. Plastik katkı maddesi erir ve yanan metal tutuşma sıcaklığının altına düşene kadar kabuğun bütünlüğünü korumasına yardımcı olur. Bu tip yangın söndürücü 1940'ların sonlarında kartuşla çalışan bir ünite olarak icat edildi, ancak depolanmış basınç versiyonları artık daha popülerdir. Yaygın boyutları 14 kg taşınabilir ve 160 kg tekerleklidir.
Temizleyici
En azından orta çağdan beri insanlar tuzu ev yüzeylerine sürtünen bir temizlik maddesi olarak kullandılar. Aynı zamanda birçok şampuan, diş macunu markasında ve araba yollarının ve buz parçalarının buzunu çözmek için yaygın olarak kullanılır.
Optik kullanım
Kusursuz NaCl kristalleri, kızılötesi ışık için, özellikle 200 nm ve 20 µm arasında, yaklaşık %90'lık bir optik geçirgenliğe sahiptir. Bu nedenle, bu spektral aralıkta çalışan emici olmayan birkaç alternatif olduğu ve mikroskobik homojensizliklerin yokluğu için gereksinimlerin görünür aralıktan daha az katı olduğu yerlerdeki optik bileşenlerde (pencereler ve prizmalar) kullanıldılar. Ucuz olmasına rağmen, NaCl kristalleri yumuşak ve higroskopiktir - ortam havasına maruz kaldıklarında yavaş yavaş "don" ile kaplanırlar. Bu, NaCl'nin kuru ortamlara, vakumla kapatılmış montaj alanlarına veya prototip oluşturma gibi kısa süreli kullanımlara uygulanmasını sınırlar. Günümüzde kızılötesi spektral aralık için NaCl yerine mekanik olarak daha güçlü ve neme karşı daha az hassas olan çinko selenit (ZnSe) gibi malzemeler kullanılmaktadır.
Kimya
Katı sodyum klorür

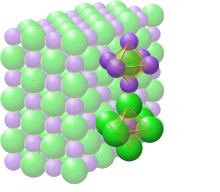
Katı sodyum klorürde, her iyon, elektrostatik zeminlerde beklendiği gibi, zıt yüklü altı iyonla çevrilidir. Çevredeki iyonlar, düzenli bir oktahedronun köşelerinde bulunur. Yakın paketleme dilinde, daha büyük klorür iyonları (167 pm boyutunda[15]) kübik bir dizide düzenlenirken, daha küçük sodyum iyonları (116 pm[15]) aralarındaki tüm kübik boşlukları (oktahedral boşluklar) doldurur. Bu aynı temel yapı, diğer birçok bileşikte bulunur ve yaygın olarak halit veya kaya tuzu kristal yapısı olarak bilinir. İki atomlu bir yüz merkezli kübik (fcc) kafes veya iç içe geçmiş iki yüz merkezli kübik kafes olarak temsil edilebilir. Birinci atom her kafes noktasında bulunur ve ikinci atom fcc birim hücre kenarı boyunca kafes noktalarının ortasında bulunur.
Katı sodyum klorürün erime noktası 801 °C’dir. Sodyum klorürün sıcaklığın bir fonksiyonu olarak Isı iletkenliği, 8 K'da (−265.15 °C) maksimum 2.03 W/(cm K)'ye sahiptir ve 314 K'de (41 °C) 0.069'a düşer. Dopingle de azalır.[16]
Atomik çözünürlüklü gerçek zamanlı video görüntüleme, sodyum klorürün kristal çekirdeklenmesinin ilk aşamasının görselleştirilmesine olanak tanır.[17]
Sulu çözeltiler
| NaCl'nin çözünürlüğü (g NaCl / 1 kg çözücü 25 °C’de)[18] | |
|---|---|
| Su | 360 |
| Formamid | 94 |
| Gliserin | 83 |
| Propilen glikol | 71 |
| Formik asit | 52 |
| Sıvı amonyak | 30.2 |
| Metanol | 14 |
| Etanol | 0.65 |
| Dimetilformamid | 0.4 |
| 1-Propanol | 0.124 |
| Sülfolan | 0.05 |
| 1-Bütanol | 0.05 |
| 2-Propanol | 0.03 |
| 1-Pentanol | 0.018 |
| Asetonitril | 0.003 |
| Aseton | 0.00042 |
Katıdaki Na+ ve Cl− iyonları arasındaki çekim o kadar güçlüdür ki, yalnızca su gibi yüksek polariteye sahip çözücüler NaCl'yi iyi çözer.

Suda çözündüğünde, Na+ ve Cl− iyonları polar su molekülleri ile çevrelendikçe sodyum klorür çerçevesi parçalanır. Bu çözeltiler, 250 pm Na–O mesafesi ile [Na(H2O)8]+ formülüne sahip metal akua kompleksinden oluşur. Klorür iyonları da güçlü bir şekilde çözülür, her biri ortalama altı su molekülü ile çevrilidir.[20] Sodyum klorür çözeltileri saf sudan çok farklı özelliklere sahiptir. Ötektik nokta, tuzun %23.31 kütle kesri için −21.12 °C'dir ve doymuş tuz çözeltisinin kaynama noktası 108.7 °C’ye yakındır.[9] Soğuk çözeltilerden tuz, dihidrat NaCl•2H2O olarak kristalleşir.[21]
Sodyum klorür çözeltilerinin pH'ı
Bir sodyum klorür çözeltisinin pH'ı, güçlü asit HCl'nin eşlenik bazı olan Cl− iyonunun aşırı derecede zayıf bazlığı nedeniyle ≈7 olarak kalır. Başka bir deyişle, iyonik güç ve aktivite katsayılarının etkilerinin ihmal edilebilir olduğu seyreltilmiş çözeltilerde NaCl'nin sistem pH’ı[22] üzerinde hiçbir etkisi yoktur.
Beklenmeyen kararlı stokiyometrik değişkenler
Adi tuz, 1: 1 molar sodyum ve klor oranına sahiptir. 2013 yılında, farklı stokiyometrilerde sodyum ve klorür bileşikleri keşfedildi; beş yeni bileşik tahmin edildi (örn., Na3Cl, Na2Cl, Na3Cl2, NaCl3 ve NaCl7). Bazılarının varlığı yüksek basınçlarda deneysel olarak doğrulanmıştır: kübik ve ortorombik NaCl3 ve iki boyutlu metalik tetragonal Na3Cl . Bu, kimyasal sezgiyi ihlal eden bileşiklerin, ortam dışı koşullar altında basit sistemlerde mümkün olduğunu gösterir.[23]
Doğada bulunuşu
Deniz tuzu'nun küçük parçacıkları, denizden uzak baskın bulut yoğunlaşma çekirdekleridir, farklı bir şekilde kirlenmemiş havada bulutların oluşmasını sağlar.[24]
Üretimi
Tuz, halen tuzlu su kuyularından ve tuz göllerinden deniz suyunun veya tuzlu suyun buharlaştırılmasıyla topluca üretilmektedir. Kaya tuzu madenciliği de önemli bir kaynaktır. Çin dünyanın ana tuz tedarikçisidir.[8] 2017'de dünya üretiminin 280 milyon ton olduğu tahmin edildi, ilk beş üretici (milyon ton olarak) Çin (68,0), Amerika Birleşik Devletleri (43,0), Hindistan (26,0), Almanya (13,0) ve Kanada (13,0).[25] Tuz aynı zamanda potasyum madenciliğinin bir yan ürünüdür.
 Amerika Birleşik Devletleri, New York, Mount Morris yakınlarındaki modern kaya tuzu madeni
Amerika Birleşik Devletleri, New York, Mount Morris yakınlarındaki modern kaya tuzu madeni
 Tuz yığınları, Salar de Uyuni, Bolivya.
Tuz yığınları, Salar de Uyuni, Bolivya.
Ayrıca bakınız
- Halit, sodyum klorürün mineral formu
- Yemek tuzu
- Tuzluluk
Kaynakça
- ^ "Sodium Chloride (NaCl) Crystal". PhysicsOpenLab. 8 Şubat 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ağustos 2021.
- ^ a b c d e f Haynes, 4,89
- ^ Haynes, 10.241
- ^ Haynes, 4.135
- ^ Haynes, 4.148
- ^ Sodium chloride 27 Haziran 2015 tarihinde Wayback Machine sitesinde arşivlendi.. nlm.nih.gov.
- ^ a b c d Westphal, Gisbert et al. (2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim DOI:10.1002/14356007.a24_317.pub4.
- ^ a b c d e f g h i j k l Kostick, Dennis S. (Ekim 2010) "Salt" 1 Temmuz 2017 tarihinde Wayback Machine sitesinde arşivlendi. in U.S. Geological Survey, 2008 Minerals Yearbook
- ^ a b Elvers, B. et al. (ed.) (1991) Ullmann's Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, 978-3-527-20124-2.
- ^ Rastogi, Nina (16 Şubat 2010) Does road salt harm the environment? 7 Eylül 2011 tarihinde Wayback Machine sitesinde arşivlendi. slate.com.
- ^ "Saltier waterways are creating dangerous 'chemical cocktails'". phys.org. 3 Aralık 2018 tarihinde kaynağından arşivlendi.
- ^ "Most Road Salt Is Making It into Lakes And Rivers". www.sciencedaily.com. University of Minnesota. 20 Şubat 2009. 14 Şubat 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Eylül 2015.
- ^ Casey, Michael. "Turning to beet juice and beer to address road salt danger". phys.org. 29 Ocak 2018 tarihinde kaynağından arşivlendi.
- ^ "EASA Cautions on Organic Salt Deicing Fluid". MRO Network. 9 Aralık 2016. 10 Ocak 2018 tarihinde kaynağından arşivlendi.
- ^ a b R. D. Shannon (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallogr A. 32 (5): 751-767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551
 .
. - ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha; Subhadra, K. G. (2001). Alkali halides: a handbook of physical properties. Springer. ss. 65, 68. ISBN 978-3-540-42180-1.
- ^ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021). "Capturing the Moment of Emergence of Crystal Nucleus from Disorder". Journal of the American Chemical Society. 143 (4): 1763-1767. doi:10.1021/jacs.0c12100
 . PMID 33475359.
. PMID 33475359. - ^ Burgess, J (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 978-0-85312-027-8.
- ^ Klewe, B; Pedersen (1974). "The crystal structure of sodium chloride dihydrate". Acta Crystallogr. B30 (10): 2363-2371. doi:10.1107/S0567740874007138
 .
. - ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) "Metal Aqua Ions" Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. DOI:10.1016/B0-08-043748-6/01055-0.
- ^ Water-NaCl phase diagram. Lide, CRC Handbook of Chemistry and Physics, 86 ed (2005-2006), CRC pages 8-71, 8-116.
- ^ "Acidic, Basic, and Neutral Salts". Flinn Scientific Chem Fax. 2016. 19 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Eylül 2018.
Neutralization of a strong acid and a strong base gives a neutral salt.
- ^ Zhang, W.; Oganov, A. R.; Goncharov, A. F.; Zhu, Q.; Boulfelfel, S. E.; Lyakhov, A. O.; Stavrou, E.; Somayazulu, M.; Prakapenka, V. B.; Konôpková, Z. (2013). "Unexpected Stable Stoichiometries of Sodium Chlorides". Science. 342 (6165): 1502-1505. arXiv:1310.7674 $2. Bibcode:2013Sci...342.1502Z. doi:10.1126/science.1244989. PMID 24357316.
- ^ Mason, B. J. (2006). "The role of sea-salt particles as cloud condensation nuclei over the remote oceans". Quarterly Journal of the Royal Meteorological Society. 127 (576): 2023-32. Bibcode:2001QJRMS.127.2023M. doi:10.1002/qj.49712757609.
- ^ Salt 22 Eylül 2018 tarihinde Wayback Machine sitesinde arşivlendi., U.S. Geological Survey
Alıntılanan kaynaklar
- Haynes, William M., (Ed.) (2011). CRC Handbook of Chemistry and Physics. 92nd. CRC Press. ISBN 978-1439855119.
- Tikhomirova (2020). "Exotic Two-Dimensional Structure: The First Case of Hexagonal NaCl". The Journal of Physical Chemistry Letters. 11 (10): 3821-3827. doi:10.1021/acs.jpclett.0c00874. PMID 32330050.
Dış bağlantılar
- Salt 16 Kasım 2017 tarihinde Wayback Machine sitesinde arşivlendi. Amerika Birleşik Devletleri Jeolojik Araştırma İstatistikleri ve Bilgileri
- "Using Salt and Sand for Winter Road Maintenance". Road Management Journal. December 1997. 21 Eylül 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Şubat 2007.
- Hesaplayıcılar: Sulu NaCl'nin (ve diğer tuzların) yüzey gerilimleri 22 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi. ve yoğunlukları, molariteleri ve molaliteleri 22 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- JtBaker MSDS 12 Şubat 2017 tarihinde Wayback Machine sitesinde arşivlendi.

![{\displaystyle {\ce {2 NaCl + 2 H2O ->[elektroliz] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/be82b49cbb982ab3c54ea6fbd3e6f873d88fc712)

















