
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Sodyum karbonat, (çamaşır sodası, kristal soda ve soda külü olarak da bilinir) Na2CO3 formülüne sahip değişik hidratları olan bir inorganik bileşiktir. Bütün formları beyaz, suda çözünür tuzlardır. Tüm formları güçlü bir alkali tada sahiptir ve suda orta derecede alkali çözeltiler verir. Tarihsel olarak sodyum bakımından zengin göl sularından veya sodyum bakımından zengin topraklarda yetişen bitkilerin küllerinden çıkarıldı. Bu sodyum açısından zengin bitkilerin külleri, potas üretmek için kullanılan odun küllerinden belirgin şekilde farklı olduğundan, "soda külü" olarak anıldı. Günümüzde ise, Solvay işlemi ile sodyum klorür ve kireç taşından büyük miktarlarda üretilmektedir.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Kostik ve kostik soda ( ) olarak da bilinen sodyum hidroksit (kostik soda veya sud kostik de denir), NaOH formülüne sahip bir inorganik bileşiktir. Sodyum katyonları Na+ ve hidroksit anyonları OH- içeren beyaz renkli katı bir iyonik bileşiktir.
) olarak da bilinen sodyum hidroksit (kostik soda veya sud kostik de denir), NaOH formülüne sahip bir inorganik bileşiktir. Sodyum katyonları Na+ ve hidroksit anyonları OH- içeren beyaz renkli katı bir iyonik bileşiktir.
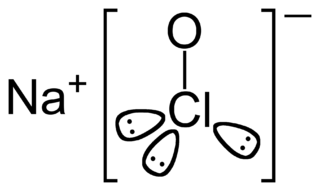
Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

Hidroksit, kimya biliminde, oksijen ve hidrojen atomları içeren diatomik anyonun adıdır. Genellikle bir bazın parçalanması sonucu ortaya çıkar. Bilinen en basit diatomik iyonlardan biridir.

Sodyum bikarbonat ya da soda kimyasal formülü NaHCO3 olan bir kimyasal bileşiktir. Kabartma tozu olarak da bilinir. Sodyum tuzlarından birisidir. Antiasit özelliği vardır. Kabartma tozu olarak da kullanılır. Suda çözünür. Beyaz katı kristal tozdur. Sodyum karbonat'ı andıran hafif alkali tadı vardır. Salin solüsyonu bileşiminde de kullanılır.

İyodat, kimyasal formülü IO3− olan bir iyodik asit tuzudur. İyodat anyonunda iyot üç oksijen atomuna bağlıdır. İyodatın moleküler geometrisi üç köşeli piramittir.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.

Sodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Sodyum perkloratın çözünürlüğü diğer perklorat tuzları içinde en yüksek olanıdır. Beyaz kristallerden oluşan ve higroskopik özellikte olan sodyum perklorat suda ve alkolde oldukça çok çözünür. Genellikle monohidrat form halinde bulunur ve rombik bir kristal yapısına sahiptir. Standart oluşum entalpisi −382.75 kJ mol−1 dir.

Sodyum klorat NaClO3 kimyasal formülüne sahip bir inorganik bileşiktir. Suda kolayca çözünür, beyaz kristal bir tozdur. Higroskopiktir. Sodyum klorat 300 °C’nin üzerinde ayrışarak oksijen ve sodyum klorür ortaya çıkar. Özellikle, çok parlak kâğıt imal etmek için ağartma hamurundaki uygulamalara yönelik olarak yılda birkaç yüz milyon ton üretilmektedir.

Sodyum bisülfat, diğer bir adı sodyum hidrojen sülfat (NaHSO4) olan bu kimyasal madde asit tuz karakterlidir. Kuru halde iken güvenli bir şekilde nakledilebilir ve depolanabilir. Susuz formu higroskopiktir. Sodyum bisülfat suda hidroliz olarak asidik çözelti verir. 1 Molarlık çözeltisinin pH değeri 1 den küçüktür. Sodyum bisülfat yavaşça ısıtılırsa suyunu kaybederek sodyum pirosülfata dönüşür.
- 2NaHSO4 → Na2S2O7 + H2O

Sodyum azotür, NaN3 formüllü inorganik bileşiktir. Bu renksiz tuz çoğu araba hava yastığı sisteminde kullanılan gaz oluşturucusudur. Diğer azotür bileşiklerinin hazırlanabilmesi için de kullanılır. İyonik bir maddede olan sodyum azotür, suda oldukça iyi çözünür ve güçlü bir toksiktir.
Sodyum hipobromit NaBrO formülüne sahip inorganik bir bileşiktir. Genellikle suyun kristalize edilmesiyle elde edildiğinden genel formülüne NaBrO.5H2O de denebilir. Sarı-turuncu renge sahip suda çözünebilir bir maddedir. İyonları Na+ BrO-'dur.

Hipoiyodöz asit, HOI kimyasal formülü ile gösterilen inorganik bir bileşiktir. Sulu bir iyot çözeltisinin cıva veya gümüş tuzları ile işlenmesi durumunda oluşur. Disproporsiyonlaşma ile hızla ayrışır:
- 5 HOI → HIO3 + 2I2 + 2H2O

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Potasyum iyodat (KIO3) bir kimyasal bileşiktir. K+ ve IO3− iyonlarından oluşur. Potasyum iyodat oksitleyici bir maddedir ve bu nedenle yanıcı maddelerle temas ettiğinde yangına neden olabilir. Suda ve sülfürik asitte çözünür; alkolde çözünmez.

Sodyum fenolat (sodyum fenoksit) NaOC6H5 formülüne sahip bir organik bileşiktir. Beyaz kristalimsi bir katıdır. Aynı zamanda fenoksit olarak da bilinen fenolat anyonu, fenolün konjuge bazıdır. Aril eterler gibi diğer birçok organik bileşiğin öncül maddesi olarak kullanılır.
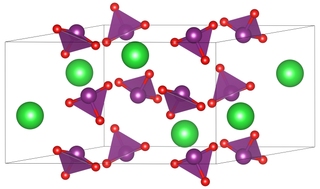
Baryum iyodat, kimyasal formülü Ba(IO3)2 olan inorganik bir kimyasal bileşiktir. Beyaz, granül bir maddedir.



 [4]
[4]


















