
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Sodyum karbonat, (çamaşır sodası, kristal soda ve soda külü olarak da bilinir) Na2CO3 formülüne sahip değişik hidratları olan bir inorganik bileşiktir. Bütün formları beyaz, suda çözünür tuzlardır. Tüm formları güçlü bir alkali tada sahiptir ve suda orta derecede alkali çözeltiler verir. Tarihsel olarak sodyum bakımından zengin göl sularından veya sodyum bakımından zengin topraklarda yetişen bitkilerin küllerinden çıkarıldı. Bu sodyum açısından zengin bitkilerin külleri, potas üretmek için kullanılan odun küllerinden belirgin şekilde farklı olduğundan, "soda külü" olarak anıldı. Günümüzde ise, Solvay işlemi ile sodyum klorür ve kireç taşından büyük miktarlarda üretilmektedir.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).

Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Formik asit, HCOOH, tek karbonlu karboksilik asittir. Metanoik asit olarak da bilinir. Formik asit, karbonil karbonuna bağlı alkil grubu içermemesiyle en basit karboksilli asit özelliği taşır. Hem aldehit hem de karboksilik asit özelliğine sahiptir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Kostik ve kostik soda ( ) olarak da bilinen sodyum hidroksit (kostik soda veya sud kostik de denir), NaOH formülüne sahip bir inorganik bileşiktir. Sodyum katyonları Na+ ve hidroksit anyonları OH- içeren beyaz renkli katı bir iyonik bileşiktir.
) olarak da bilinen sodyum hidroksit (kostik soda veya sud kostik de denir), NaOH formülüne sahip bir inorganik bileşiktir. Sodyum katyonları Na+ ve hidroksit anyonları OH- içeren beyaz renkli katı bir iyonik bileşiktir.

Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.
Hidrazin (N2H4), amonyaktaki bir hidrojen yerine NH2 (amino) grubunun geçmesi sonucunda oluşur. Hidrazindeki her bir N atomunun yükseltgenme basamağı (değerlik) -2'dir. Hidrazin bifonksiyonel bir bazdır. Susuz N2H4, dumanlar oluşturan renksiz ve yanıcı bir sıvıdır. Saf hidrazin, örneğin hidrazin hidrat gibi sulu çözelti içinde işlenmedikçe oldukça toksiktir.

Sodyum nitrat formülü NaNO3 olan kimyasal bileşiktir. Güherçile'den ayırmak için Şili güherçilesi (bu ülkede büyük miktarda yığınlar halinde bulunması nedeniyle bu ad verilmiştir) adı da verilen bu beyaz renkli kristal tuz, potasyum nitrata oranla suda çok fazla çözünmektedir. Havadan nem çeker.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.

Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.

MeOAc, asetik asit metil esteri ya da metil etanoat olarak da bilinen Metil asetat, formülü CH3COOCH3 olan karboksilli bir esterdir. Karakteristik olarak, bazı tutkallar ve oje çıkarıcıların hoş kokusunu anımsatan yanıcı bir sıvıdır. Metil asetat, zayıf polar ve lipofilik özellikte olduğundan bazen bir solvent olarak kullanılmaktadır. Ancak yakın akrabası olan etil asetat daha az toksik ve suda daha az çözündüğünden dolayı çok daha yaygın kullanılan bir çözücüdür. Metil asetat, oda sıcaklığındaki su içerisinde %25 kadar bir çözünürlüğe sahiptir. Yüksek sıcaklıktaki suda, çözünürlüğü çok daha yüksektir. Metil asetat kuvvetli sulu bazlar ya da sulu asitlerin mevcudiyetinde kararlı değildir.
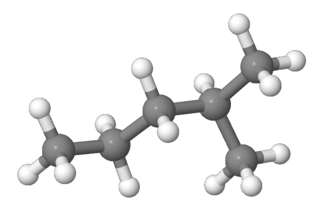
2-metilpentan ya da izoheksan, C6H14 moleküler formülüne sahip dallanmış zincirli bir alkandır. Pentan zincirinde ikinci karbon atomuna bağlı bir metil grubundan oluşan bir hekzan yapısal izomeridir.

Metil Metakrilat (MMA), CH
2C(CH
3)COOCH
3 formüllü organik bileşik. Metakrilik asitin Metil esteridir. Renksiz, yanıcı bir sıvıdır. Polimer üretimi için her yıl tonlarca MMA monomeri üretilir. Erime noktası -48 °C, kaynama noktası 101 °C'dir.

Metanamid olarak da bilinen formamid, formik asitin amididir. Su ile karışabilen ve amonyak benzeri bir kokuya sahip berrak bir sıvıdır. Sülfa ilaçları, diğer farmasötikler, herbisitler, böcek ilaçları ve hidrosiyanik asit üretimi için kimyasal hammaddedir. Kâğıt ve elyaf için yumuşatıcı olarak kullanılmıştır. Birçok iyonik bileşik için bir çözücüdür. Reçineler ve plastikleştiriciler için bir çözücü olarak da kullanılmıştır.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.

Kimyasal atık, çoğunlukla büyük fabrikalarda üretilen kimyasallardan açığa çıkan atıktır. Kimyasal atıklar çevreye zarar verebilir ve sağlık sorunlarına neden olabilir. Bu nedenle kimyasal atıklar Birleşik Krallık'taki COSHH veya ABD'deki Clean Water Act ve Resource Conservation and Recovery Act gibi yasal düzenlemelere tabi olabilirler. ABD'de, Çevre Koruma Ajansı (EPA), Mesleki Güvenlik ve Sağlık İdaresi (OSHA) ve eyalet yönetmelikleri ile yerel yönetmelikler de kimyasalların kullanımı ve bertarafını düzenlemektedir. Radyoaktif atıkların bertarafı ve yönetimi, radyasyonun çevre ve sağlık açısından riskleri ve emniyetli bir biçimde bertaraf etme zorlukları nedeniyle düzenleyici kurumların çalışmalarında odaklanılan noktalardan biridir.
Kloropikrin, şu anda geniş spektrumlu bir antimikrobiyal, fungisit, herbisit, insektisit ve nematisit olarak kullanılan bir kimyasal bileşiktir. Birinci Dünya Savaşı'nda zehirli gaz olarak kullanılmıştır. Kimyasal yapı formülü Cl
3CNO
2'dir.
Morfolin, O(CH
2CH
2)
2NH kimyasal formülüne sahip organik bir kimyasal bileşiktir. Bu halkalı bileşik, hem amin hem de eter fonksiyonel grupları içerir. Amin nedeniyle morfolin bir bazdır; konjuge asidine morfolinyum denir. Örneğin, morfolinin hidroklorik asitle işlenmesi, morfolinyum klorür tuzunu oluşturur. Zayıf, amonyak veya balık benzeri bir kokuya sahip, renksiz bir sıvıdır. Morfolinin adlandırılması, onun morfinin yapısının bir parçası olduğuna inanan Ludwig Knorr'a atfedilir.






 HN3 + OH- (K = 10−4.6
HN3 + OH- (K = 10−4.6















