Elektronegatiflik, kimyada bağ yapımında kullanılan elektronların bağı oluşturan atomlar tarafından çekilme gücüdür. Klor gibi dış enerji seviyeleri hemen hemen tamamen doldurulmuş atomlar güçlü elektronegatiftirler ve kolaylıkla elektron alırlar. Buna karşın sodyum gibi dış seviyeleri hemen hemen boş olan atomlar kolaylıkla elektronlarını verirler ve güçlü elektropozitiftirler. Elektronegatifler ile elektron ilgileri karıştırılmamalıdır.

Baryum (Yunanca'da βαρυς = ağır), sembolü Ba olan kimyasal bir elementtir. Ağır manasına gelen "barys" kelimesinden türemiştir. İngilizcede Barite ağırlık yoğunluk manasında kullanılmaktadır. Baryum elementinin atom numarası 56 olup Periyodik tablonun 6. sırasında ve 2. grubunda bulunur. 2. grupta bulunması özelliğinden dolayı Baryum bir toprak alkali metalidir. Baryum ilk defa 1774 yılında İsveçli kimyacı Carl Wilhelm Sheele tarafından tanımlanmıştır. Baryum element halinde beyaz-gri metalik rengindedir fakat yüksek reaktivitelikten dolayı element halinde bulunmaz. Baryum'un hemen hemen bütün bileşikleri ise zehirlidir. Metalik Ba yakıldığında elma yeşili bir renk verir. Metalik halde saklanması çok zordur. Aktif bir element olduğu için su, hava ve asitlerle kolayca reaksiyon verir. Toprak alkali grup içerisinde doğada en yaygın bulunan element Kalsiyum(Ca)dur. Bu sınıftaki metallerin özellikleri birbirine benzemesine karşın bilhassa Kalsiyum, Stronsiyum, Baryum diğerlerinden ayrılır. Bu üç element adi derecede suyu ayrıştırarak Hidrojen açığa çıkarır ve Hidroksit(OH) oluştururlar. Bu Hidroksitler de ısıtıldığında su kaybederek Oksit haline dönmektedirler. Karbonatları ısı karşısında kolay ayrışmasına karşın Baryum Karbonat (BaCO3) en zor ayrışanıdır. Sülfatları suda hemen hemen hiç erimez.
Fizikte, kütle, Newton'un ikinci yasasından yararlanılarak tanımlandığında cismin herhangi bir kuvvet tarafından ivmelenmeye karşı gösterdiği dirençtir. Doğal olarak kütlesi olan bir cisim eylemsizliğe sahiptir. Kütleçekim kuramına göre, kütle kütleçekim etkileşmesinin büyüklüğünü de belirleyen bir çarpandır (parametredir) ve eşdeğerlik ilkesinden yola çıkılarak bir cismin kütlesi kütleçekimden elde edilebilir. Ama kütle ve ağırlık birbirinden farklı kavramlardır. Ağırlık cismin hangi cisim tarafından kütleçekime maruz kaldığına göre ve konumuna göre değişebilir.

Proton, atom çekirdeğinde bulunan artı yüklü atomaltı parçacıktır. Elektronlardan farklı olarak atomun ağırlığında hesaba katılacak düzeyde kütleye sahiptirler. Şimdiye kadar Protonların İki yukarı bir aşağı kuarktan oluştuğu kabul edilse de yeni yapılan bilimsel çalışmalarda araştırmacılar protonun kütlesinin yüzde 9'unun kuarkların ağırlığından, yüzde 32'sinin protonun içindeki kuarkların hızlı hareketlerinin meydana getirdiği enerjiden, yüzde 36'sının protonun kütlesiz parçacıkları olan ve kuarkları bir arada tutmaya yardımcı olan gluonların enerjilerinden, geriye kalan yüzde 23'lük bölümünse kuarkların ve gluonların protonun içinde karmaşık şekillerde etkileşimlerde bulunduklarında meydana gelen kuantum etkimelerden oluştuğunu buldular. Evrendeki bütün protonlar 1,6 x 10−19 değerinde pozitif yüke sahiptirler. Bu, atomlardaki çeşitli protonların birbirlerini itmelerini sağlar. Ama aradaki çekim, itmeden 100 kez daha güçlü olduğu için protonlar birbirlerinden ayrılmazlar. Protonun kütlesi elektronunkinden 1836 kat fazladır. Buna karşın, bilinmeyen bir nedenden ötürü elektronun yükü protonunkiyle aynıdır: 1,6 x 10−19 C. Atom içinde her biri (+1) pozitif elektrik yükü taşıyan taneciğe proton denir. Bu yüke yük birimi denir. Protonun yüklü elektronun yüküne eşit fakat ters işaretlidir.Bir protonun yoğunluğu yaklaşık olarak 4 x 1017 Kg/m³ 'tür. (2,5 x 1016 Lb/Ft3)

Triiyodotironin veya T3; tiroit bezi tarafından salgılanan, iki adet tirozin aminoasitinden oluşan, iyot atomları içeren bir hormondur.

Katı, maddenin atomları arasındaki boşluğun en az olduğu halidir. "Katı" olarak adlandırılan bu haldeki maddelerin kütlesi, hacmi ve şekli belirlidir. Bir dış etkiye maruz kalmadıkça değişmez. Sıvıların aksine katılar akışkan değildir. Fiziksel yollarla, diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. Altın demir gibi madenler katı maddelere örnektir. Ayrıca katı maddeler atomlarının en yavaş hareket edebildiği haldir. Doğa'da amorf veya kristal yapıda bulunurlar. Amorf katılar maddenin taneciklerinin düzensiz olma durumudur. Kristal katılar ise de maddenin taneciklerinin düzenli olma durumudur. Kristal katılar da aralarında 4'e ayrılır.
Kimya ve biyokimyada, yağ asidi, genelde uzun, alifatik kuyruklu bir karboksilik asittir. Uzun karboksilik yağ asitlerinden 4 karbonlu ve daha uzun zincirlileri yağ asidi olarak sayılır; doğal yağları (trigliseritleri) oluşturan yağ asitlerinden söz ederken ise bunların en az 8 karbonlu olduğu varsayılabilir. Çoğu doğal yağ asitlerinin çift sayılı karbon atomu vardır, çünkü bunların biyolojik sentezlerinde iki karbon atomlu asetat kullanılır.

Atom çekirdeği, atomun merkezinde yer alan, proton ve nötronlardan oluşan küçük ve yoğun bir bölgedir. Atom çekirdeği 1911 yılında Ernest Rutherford tarafından keşfedildi. Bu keşif, 1909 yılında gerçekleştirilen Geiger-Marsden deneyine dayanmaktadır. Nötronun James Chadwick aracılığıyla 1932 yılında keşfinden sonra, çekirdeğin proton ve nötronlardan oluştuğu modeli Dmitri Ivanenko ve Werner Heisenberg tarafından çabucak geliştirildi. Atomun kütlesinin neredeyse tamamı çekirdek içerisindedir, elektron bulutunun atom kütlesine katkısı oldukça azdır. Proton ve nötronlar çekirdek kuvveti tarafından çekirdeği oluşturmak için birbirlerine bağlanmıştır.

Alfred Kastler, Almanya doğumlu Fransız fizikçi. 1966 yılında Nobel Fizik Ödülü'nü kazandı.
Termodinamikte, geri döndürülemez olan işlemlere tersinmez denir. Termodinamiğin bu bakış açısına göre, doğal olan bütün işlemler tersinmezdir. Tersinmezlik olgusu, bir termodinamik sistemde etkilenen moleküller başka bir termodinamik sisteme aktarılsa bile, yeni termodinamik sistemdeki atom ve moleküllerin diziliş ve düzenlerinin eski termodinamik sistemdekinden farklı olması nedeniyle oluşmaktadır. Belirli bir miktarda "dönüşüm enerjisi","çalışan cisim" molekülleri bir halden başka bir hale geçerken birbirleri üzerinde iş yaptıkları için harcanmalıdır. Bu dönüşüm esnasında belirli bir miktar ısı enerjisi moleküller arası sürtünme ve çarpışmalar nedeniyle kaybedilecek veya dağılacaktır. Bu enerji işlem ters çevirildiğinde geri kazanılabilir olmayacaktır. Bu durum Rudolf Clausius tarafından "Termodinamik süreçte kullanılabilir olmayan bir miktar ısı vardır." şeklinde ifade edilmiştir.

Sikloalkan ; karbon atomları arasında bir ya da daha fazla sayıda halka bulunduran molekülleri kapsayan hidrokarbon bileşiklerinin genel adıdır. Alkanlar gibi moleküldeki her bir atom arasında yalnızca birer tane kimyasal bağ bulunmaktadır. Sikloalkanlarda yalnızca karbon ve hidrojen atomları yer almaktadır. Sikloalkanlar doymuş yapıdadır, çünkü hidrojenasyon gerçekleştirilemez.

Siklobütan (İngilizce: Cyclobutane); molekül formülü (CH2)4 olan, organik bir bileşiktir. Siklobütan bir sikloalkan bileşiğidir. Bir tane halkaya sahiptir. Siklobütan renksizdir, sıvılaştırılmış biçimde ticari olarak temin edilebilir. Siklobütanın tek başına ciddi bir ticari veya biyolojik bir değeri yoktur, ancak siklobütanın karmaşık türevleri hem ticari olarak hem de biyolojik olarak büyük önem ihtiva edebilir. Biyoteknolojide karmaşık türevleri çok önemli bir yere sahiptir. Siklobütanın erime noktası −91 °C, kaynama noktası 12.5 °C olup, yoğunluğu 0.720 g/cm³'tür.

Soğurma, ışığın bir cisim tarafından emilmesidir. Her cisim, yalnızca kendi rengindeki ve kendi rengini oluşturan renklerdeki ışıkları yansıtabilir. Her cisim soğuramadığı renkte görünür. Siyah renkli cisimler, bütün renkleri soğurur. Işığı fazla soğuran cisimler, az soğuran cisimlere göre daha hızlı ısınır.

Alisiklik bileşik, hem alifatik hem de siklik olan organik bir bileşiktir. Bunlar, doymuş veya doymamış olabilen, ancak aromatik karakterde olmayan bir veya daha fazla tüm-karbon halkası içerir. Alisiklik bileşikler bağlı bir veya daha fazla alifatik yan zincir içerebilir.
Siklobütin, C4H4 kimyasal formülüne sahip bir hidrokarbon molekülüdür. Dörtlü karbon atomu halkası içerisinde bir üçlü bağ barındırır. Bu sikloalkin yüksek halka gerilimi nedeniyle çok dengesizdir ve saf halde izole edilmemiştir. Bununla birlikte, siklobütin içeren osmiyum koordinasyon kompleksleri sentezlenmiştir.
Siklobüten bir sikloalkendir. Pratik uygulamalar için değil, temel bir değer olarak ilgi çekicidir. Renksiz, kolay yoğunlaşan bir gazdır. Modern bir sentezi, siklobütanolün 2 aşamalı dehidrasyonunu ile gerçekleşir. Bileşik ilk önce [C4H7NMe3]OH, amonyum tuzunun termolizi ile hazırlanmıştır.
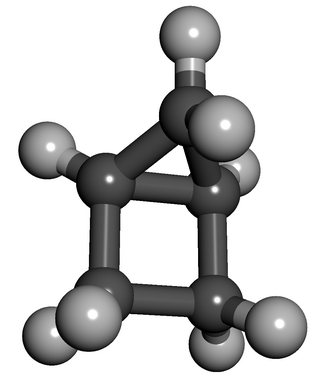
Housan veya bisiklo[2.1.0]pentan C5H8 formülüne sahip doymuş bir sikloalkandır. Oda sıcaklığında renksiz uçucu bir sıvıdır. Şekli nedeniyle "housan" (İngilizcede ev anlamına gelen "house" kelimesinden gelir) ismi verilmiştir. Yapısal olarak, molekül siklobütan ile kaynaşmış siklopropandan oluşur. Housan gibi çok sayıda gerilmiş halka içeren moleküllerin sentezi, sentetik organik kimyada geleneksel bir çabadır. Bu bileşik, siklopentadien ile başlayan birkaç aşamada hazırlanır.

Siklopenten, C5H8 kimyasal formülüne sahip bileşik. Benzin benzeri bir kokuya sahip renksiz bir sıvıdır. Bir sikloalkendir.
Siklopentin, halkada beş karbon atomu içeren bir sikloalkindir. Alkinin her atomunda 180°'lik ideal bağ açısı, bağların bir halka oluşturması için gereken yapısal gereksinimden dolayı, oldukça gergin bir yapı oluşturur ve üçlü bağ oldukça reaktifdir. Üçlü bağ, hem [2 + 2] hem de [4 + 2] sikloekleme reaksiyonlarına kolayca maruz kalır. Alken partnerinde stereokimya kaybıyla [2 + 2] ilaveye tabi tutulan benzinden farklı olarak, siklopentin eşin geometrisinin tutulmasıyla alkenlerle tepkimeye girer, yüksek reaktif yapılar için bile orbital simetrinin uygunluğunun bir örneğidir. Yapı aynı zamanda, sikloekleme tepkimesini etkileyen lityum katyonlarıyla bir kompleks de oluşturabilir. Yeni bir metalasikl oluşturmak için bakır türleriyle yeterince güçlü etkileşime girebilir.

Kare düzlemsel moleküler geometri, bazı bileşiklerde görülen ve molekülleri oluşturan atomların, merkezdeki bir atomun çevresinde bir kare oluşturacak şekilde bağlandığı moleküler geometri çeşididir. Trans- ve cis-PtCl2(NH3)2 bileşiklerinde gözlemlediği yapının ardından Alfred Werner tarafından ortaya atılmıştır.
 Siklopropen
Siklopropen

 Sikloheksen
Sikloheksen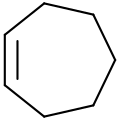 Siklohepten
Siklohepten 1,3-Siklohekzadien
1,3-Siklohekzadien 1,4-Siklohekzadien
1,4-Siklohekzadien 1,5-siklooktadien
1,5-siklooktadien











