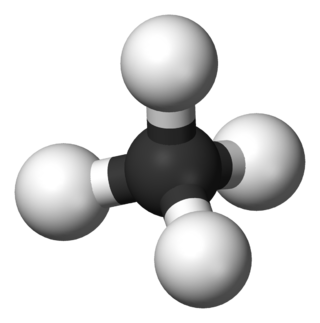
Hidrokarbon, sadece karbon ve hidrojen atomlarından oluşan kimyasal bileşiklerin genel adı.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.
Deoksiriboz veya bilinen adlarıyla D-Deoksiriboz ve 2-deoksiriboz, beş karbon atomu içeren ve aldehit grubu barındıran aldopentozların bir üyesidir. Deoksiriboz, penton riboz şekerinin 2 pozisyonundaki hidroksil grubunun hidrojen ile yer değiştirmesiyle oluşur, yani bu bir oksijen atomunun kaybı ile sonuçlanır. Hidroksil grubunun değişmesi aynı zamanda, halka yapısını C3'-endo pozisyonundan C2'-endo olacak şekilde değiştirir. Bu molekül, 1929 yılında Phoebus Levene tarafından keşfedilmiştir ve DNA nükleik asidinin önemli bir yapıtaşıdır.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.
Hidrojenasyon, bir kimyasal reaksiyon sınıfıdır ve organik bileşiklere hidrojen (H2) eklenmesi işlemidir. Hidrojenasyon, özellikle doymamış organik bileşikler (alkenler, alkinler, ketonlar ve nitriller ) için önemli bir reaksiyondur. Genellikle basınç altında katalizörler yardımı ile direkt hidrojen eklemesi ile gerçekleştirilir. Hidrojenasyon için en klasik örnek, alkenlerdeki doymamış karbon kimyasal bağına bir hidrojenin ekleyerek, alkeni alkana dönüştürmektir. İlaç ve petrokimya endüstrisinde çok değişik uygulamaları vardır. Bu kimyasal işlemin tersi dehidrojenasyondur. Alkenlere hidrojenin katılması sonucunda Alkanlar oluşur. Alkankar sadece karbon-karbon tekli bağlara sahiptirler. Bu tepkimede katalizör kullanıldığından katalitik hidrojenleme olarak da adlandırılır. Alkenlere hidrojen katılma tepkimeleri ekzotermik tepkimeler olup oda sıcaklığında katalizörsüz tepkime gerçekleşmez. Burada katalizör kullanılarak tepkimenin oda sıcaklığında gerçekleşmesi sağlanır. Yalnız katalizörün etkisi bununla sınırlı kalmıyor. Kullanılan katalizör elde edilecek olan ürünün cis-Alkan ya da trans-Alkan olmasını etkilemektedir. Eğer kullanılan katalizör heterojen bir katalizör ise, (bir parça nikel, platin, paladyum) yani çözelti içerisinde heterojen olarak karışıyorsa katılan her iki hidrojen atomu alkenin aynı tarafına eklenir ve böylece cis-Alkan oluşur. Şayet bu katalizör çözelti içerisinde homojen olarak yayılan bir katalkizörse bu seferde trans-Alkan oluşmuş olacak.
Dalton atom modeli, John Dalton'un 1805 yılında bugünkü atom modelinin ilk temellerini attığı modelidir. Katlı oranlar yasasını bulmuştur. Dalton'un atom kuramına göre elementler, kimyasal bakımdan birbirinin aynı olan atomlar içerirler. Farklı elementlerin atomları birbirinden farklıdır. Bu atom teorisine göre kimyasal bir bileşik, iki veya daha çok sayıda elementin basit bir oranda birleşmesi sonucunda meydana gelir. Kimyasal tepkimelere giren maddeler arasındaki kütle ilişkilerine istinaden, Dalton atomların bağıl kütlelerini de bulmuştur.
Kimyasal formül, bir kimyasal birleşiği oluşturan atomlar hakkında detaylı ve açık bilgi veren bir yöntemdir. Moleküler bileşikler için, içindeki elementleri kimyasal sembolleriyle, o elementlerin sayısını da o atomun yanındaki sayılarla belirtirler. Eğer bir molekül, birden çok atom içeriyorsa, bu atomların nicelikleri, yanlarında altyazı olarak belirtilir. İyonik bileşikler ve moleküler olmayan maddeler içinse, atomların girdiği oranlar, bu altyazılarla belirtilir.
Organik kimyada bir sübstitüent, bir hidrokarbon zincirindeki hidrojen atomlarından birinin yerini almış bir atom veya atomlar grubudur. Bir sübstitüente sahip olan bir organik bileşikler isimlendirilirken -il soneki kullanılır. Sübstitüenti olan bir hidrokarbon adlandırılırken, sübstitüentin bağlı olduğu karbon atomunun yer numarası da belirtilir, eğer bu bilgi yapısal izomerleri ayırt etmek için gerekliyse. Bir sübstitüentin polar etkisi endüktif etki ile mezomerik etkinin bileşimidir. Sübstitüentin işgal ettiği hacim sterik etkilere de yol açar.

Eterler, iki organik kısmın bir oksijen atomu üzerinden birbirine bağ yapmış organik moleküllerdir. Eterlerin genel formülü R-O-R' şeklindedir. Buradaki R ve R' aynı olabileceği gibi farklı organik kısımlar da olabilirler.

Kimyada istiflenme, genelde aromatik olan moleküllerin atomlar arası etkileşerek deste şeklinde üst üst üste gelmesidir. İstiflenmiş bir sistemin en yaygın bilinen örneği DNA molekülünde birbirini takibeden bazlarda görülür. İstiflenme proteinlerde, non-polar iki halkanın örtüşmesi halinde de meydana gelir. Hangi moleküllerarası kuvvetlerin istiflenmeye neden olduğu hâlen tartışma konusudur.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.
Halojenleme veya halojenasyon, bir bileşiğe bir veya daha fazla halojenin katılmasını gerektiren kimyasal bir reaksiyondur. Alkenler, klor ve brom gibi halojenlerle, nükleofillik özelliği göstermeyen çözücüler içerisinde hızla tepkimeye girerler ve dihalojenleri oluştururlar. Bromun katılması daha kolay takip edilebilmektedir. Çünkü kırmızı-kahve rengi olan Brom çözeltisinin rengi ortadan kalkar. Bu yöntem özellikle çift bağların varlığını kanıtlamada kullanılır. Burada alken doymamış bir molekül olduğu için bromla tepkimeye girerken, alkanlar ise ortamda radikal bir çözelti olmadığı sürece tepkime vermez. Genel itibarıyla bu tepkimeler ya oda sıcaklığında ya da soğuk bir ortamda inert halojen çözücülerinin (CCl4) varlığında uygulanır.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.

Adamantan (İngilizce: adamantane); formülü C10H16, erime noktası 269 °C olan, hidrokarbonlarda iyi çözünen, hafif kâfur kokulu, renksiz kristal yapılı bir maddedir. Sikloalkan yapıda olan elmasımsı bir maddedir. Adamantan moleküllerinin karbon atomlarının uzaysal düzeni elmas kristalleri ile aynı yapıya sahiptir. Adamantan molekülleri "koltuk" konfigürasyonunda düzenlenmiş, birbirine bağlı dört sikloheksan halkasından oluşur. Adamantan molekülleri "kayık" konfigürasyonunda da bulunabilir.
Siklopentan; yüksek yanıcılığa sahip olan bir sikloalkandır.

Alisiklik bileşik, hem alifatik hem de siklik olan organik bir bileşiktir. Bunlar, doymuş veya doymamış olabilen, ancak aromatik karakterde olmayan bir veya daha fazla tüm-karbon halkası içerir. Alisiklik bileşikler bağlı bir veya daha fazla alifatik yan zincir içerebilir.
Organik kimyada, bir bileşiğin karbon sayısı her moleküldeki karbon atomlarının sayısıdır. Hidrokarbonların özellikleri, karbon sayısı ile ilişkilendirilebilir, ancak karbon sayısı tek başına organik bileşiğin doygunluğunun bir göstergesini vermez. Belirli bir molekülü tarif ederken, "karbon sayısı" aynı zamanda bir zincirdeki belirli bir karbon atomunun sıra pozisyonudur.










