Senesens

Senesens (/sɪˈnɛsəns/) veya biyolojik yaşlanma, canlı organizmalarda fonksiyonel özelliklerin kademeli olarak bozulmasıdır. Senesens kelimesi hücresel senesensi ya da tüm organizmanın senesensini ifade edebilir. Organizmal yaşlanma, en azından bir organizmanın yaşam döngüsünün sonraki kısmında, artan yaşla birlikte ölüm oranlarında bir artış ve/veya fekonditede bir azalma içerir,[1][2] ancak geciktirilebilir. 1934 yılında kalori kısıtlamasının sıçanlarda yaşam süresini %50 oranında uzatabileceğinin keşfedilmesi, ihmal edilebilir yaşlanmaya sahip türlerin varlığı ve Hidra cinsi üyeleri gibi potansiyel olarak ölümsüz organizmaların varlığı, yaşlanmayı ve dolayısıyla yaşa bağlı hastalıkları geciktirmeye yönelik araştırmaları motive etmiştir. Nadir görülen insan mutasyonları yaşlanmayı hızlandıran hastalıklara neden olabilir.
Çevresel faktörler yaşlanmayı etkileyebilir - örneğin, ultraviyole radyasyona aşırı maruz kalmak cildin yaşlanmasını hızlandırır. Beyin, kardiyovasküler sistem ve kaslar da dahil olmak üzere vücudun farklı bölümleri farklı oranlarda ve belirgin bir şekilde yaşlanabilir. Benzer şekilde, hareket kontrolü ve hafıza gibi işlevler de yaşlanmayla birlikte belirgin bir şekilde azalabilir. Aynı türden iki organizma da farklı oranlarda yaşlanabilir, bu da biyolojik yaşlanma ve kronolojik yaşlanmayı farklı kavramlar haline getirir.
Tanım ve özellikler
Organizmal senesens, tüm organizmaların yaşlanmasıdır. Aktüeryal senesens, yaşla birlikte ölüm oranında artış ve/veya fekonditede azalma olarak tanımlanabilir. Gompertz-Makeham ölümlülük yasası, ölüm oranının yaşa bağlı bileşeninin yaşla birlikte üstel olarak arttığını söyler.
Yaşlanma, strese yanıt verme yeteneğinin azalması, homeostatik dengesizliğin artması ve kanser ve kalp hastalığı da dahil olmak üzere yaşlanmayla ilişkili hastalık riskinin artması ile karakterize edilir. Yaşlanma, "fizyolojik işlevin ilerleyici bir şekilde bozulması, yaşa bağlı canlılık kaybı ve kırılganlığın artması süreci" olarak tanımlanmıştır.[3]
2013 yılında bir grup bilim insanı, memelilere vurgu yaparak organizmalar arasında ortak olan yaşlanmanın dokuz ayırt edici özelliğini tanımladı:
- genomik istikrarsızlık
- telomer yıpranması
- epigenetik değişiklikler
- proteostaz kaybı
- düzensiz besin algılama
- mitokondriyal disfonksiyon
- hücresel yaşlanma
- kök hücre tükenmesi
- değişmiş hücreler arası iletişim[4]
On yıllık güncellemede üç ayırt edici özellik eklenmiş ve toplamda 12 ayırt edici özellik önerilmiştir:
- devre dışı makrootofaji
- kronik inflamasyon
- disbiyoz[5]
Çevre, DNA hasarı ve oksijen radikallerinin (yaygın olarak serbest radikaller olarak bilinir) doku ve hücrelere verdiği hasar gibi çeşitli seviyelerde hasara neden olur ve bu hasarın bir kısmı onarılmaz ve dolayısıyla zamanla birikir.[6] Eşey hücreleri yerine somatik hücrelerden klonlama, hayata daha yüksek bir başlangıç hasar yüküyle başlayabilir. Koyun Dolly bulaşıcı bir akciğer hastalığı nedeniyle genç yaşta ölmüştür, ancak ölüm oranlarını ölçmek ve yaşlanmayı ölçmek için klonlanmış bireylerden oluşan bir popülasyonun tamamına ilişkin veriler gerekli olacaktır.[]
Evrim teorisyeni George Williams şöyle yazmıştır: "Görünüşte mucizevi bir morfogenez başarısından sonra, karmaşık bir metazoanın çok daha basit bir görev olan sadece oluşmuş olanı muhafaza etme görevini yerine getirememesi dikkat çekicidir."[7]
Türler arasında çeşitlilik
Ölüm oranının yaşla birlikte arttığı farklı hızlar, türler arasında farklı maksimum yaşam sürelerine karşılık gelir. Örneğin, bir fare 3 yaşında, bir insan 80 yaşında yaşlıdır[8] ve ginkgo ağaçları 667 yaşında bile yaşın çok az etkisini gösterir.[9]
Hücre bölünmesi sırasında "ana" ve "yavru" hücreler arasında asimetri olan bakteriler de dahil olmak üzere neredeyse tüm organizmalar yaşlanır; ana hücre yaşlanırken yavru hücre gençleşir.[10][11] Hidra cinsi gibi bazı gruplarda ihmal edilebilir bir yaşlanma vardır.[12] Planaryan yassı solucanları "yüksek oranda çoğalan yetişkin kök hücre popülasyonu tarafından beslenen görünüşte sınırsız telomer rejeneratif kapasitesine" sahiptir.[13] Bu planaryanlar biyolojik olarak ölümsüz değildir, aksine ölüm oranları yaşla birlikte yavaşça artar. Biyolojik olarak ölümsüz olduğu düşünülen organizmaların bir örneği, yetişkinlik döneminde strese maruz kaldığında gençliğine geri dönme yeteneği nedeniyle "ölümsüz denizanası" olarak da bilinen Turritopsis dohrnii'dir.[14] Üreme sisteminin bozulmadan kaldığı ve Turritopsis dohrnii'nin gonadlarının bile mevcut olduğu gözlemlenmiştir.[15]
Bazı türler, üreme kapasitesinin arttığı veya sabit kaldığı ve yaşlanma sırasında artan vücut büyüklüğünün avantajlarından kaynaklanan ölüm oranının yaşla birlikte düştüğü "negatif senesens" sergiler.[16]
Yaşlanma teorileri
Yaşlanmanın doğasını (mekanizmalarını) ve nedenlerini (doğal ortaya çıkış nedenleri veya faktörleri) açıklamak için 300'den fazla farklı teori ortaya atılmıştır.[17] İyi teoriler hem geçmiş gözlemleri açıklar hem de gelecekteki deneylerin sonuçlarını tahmin eder. Bazı teoriler birbirini tamamlayabilir, örtüşebilir, çelişebilir veya diğer çeşitli teorileri engellemeyebilir.[]
Yaşlanma teorileri, evrimsel yaşlanma teorileri ve mekanistik yaşlanma teorileri olmak üzere iki geniş kategoriye ayrılır. Evrimsel yaşlanma teorileri öncelikle yaşlanmanın neden gerçekleştiğini açıklar,[18] ancak süreci yönlendiren moleküler mekanizma(lar) ile ilgilenmez. Tüm evrimsel yaşlanma teorileri, doğal seçilim gücünün yaşla birlikte azaldığı temel mekanizmalarına dayanır.[19][20] Mekanistik yaşlanma teorileri, yaşlanmanın programlanmış olduğunu öne süren teoriler ve hasar birikimi teorileri, yani yaşlanmanın zaman içinde meydana gelen belirli moleküler değişikliklerden kaynaklandığını öne sürenler olarak ikiye ayrılabilir.
Yaşlanma süreci farklı teorilerle açıklanabilmektedir. Bunlar evrimsel teoriler, moleküler teoriler, sistem teorileri ve hücresel teorilerdir. Yaşlanmanın evrimsel teorisi ilk olarak 1940'ların sonunda ortaya atılmıştır ve kısaca mutasyonların birikimi (yaşlanmanın evrimi), tek kullanımlık soma ve antagonistik pleiotropi hipotezi ile açıklanabilir. Yaşlanmanın moleküler teorileri gen regülasyonu (gen ifadesi), kodon kısıtlaması, hata felaketi, somatik mutasyon, genetik materyal (DNA) hasarı birikimi (yaşlanmanın DNA hasarı teorisi) ve farklılaşma bozukluğu gibi olguları içerir. Sistem teorileri yaşlanmaya immünolojik yaklaşımı, yaşam hızını ve nöroendokrinal kontrol mekanizmalarındaki değişiklikleri içerir. (Bkz. homeostaz). Yaşlanmanın hücresel teorisi telomer teorisi, serbest radikal teorisi (yaşlanmanın serbest radikal teorisi) ve apoptozis olarak kategorize edilebilir. Yaşlanmanın kök hücre teorisi de hücresel teorilerin bir alt kategorisidir.
Evrimsel yaşlanma teorileri
Antagonistik pleiotropi
Bir teori George C. Williams tarafından önerilmiştir[7] ve antagonistik pleiotropiyi içerir. Tek bir gen birden fazla özelliği etkileyebilir. Yaşamın erken dönemlerinde uygunluğu artıran bazı özelliklerin yaşamın ilerleyen dönemlerinde olumsuz etkileri de olabilir. Ancak, genç yaşlarda yaşlı yaşlardan çok daha fazla birey hayatta olduğu için, erken yaşlardaki küçük olumlu etkiler bile güçlü bir şekilde seçilebilir ve daha sonraki büyük olumsuz etkiler çok zayıf bir şekilde seçilebilir. Williams aşağıdaki örneği önermiştir: Belki de bir gen kemiklerde kalsiyum birikimini kodlar, bu da gençlerin hayatta kalmasını teşvik eder ve bu nedenle doğal seçilim tarafından tercih edilir; ancak aynı gen arterlerde kalsiyum birikimini teşvik ederek yaşlılıkta olumsuz aterosklerotik etkilere neden olur. Dolayısıyla, yaşlılıktaki zararlı biyolojik değişiklikler, yaşamın erken dönemlerinde faydalı olan ancak daha sonra zararlı olan pleiotropik genler için seçilimden kaynaklanabilir. Bu durumda, Fisher'ın üreme değeri yüksek olduğunda seçilim baskısı nispeten yüksek, Fisher'ın üreme değeri düşük olduğunda ise nispeten düşüktür.
Yaşlanmanın kansere karşı hücresel yaşlanma değiş tokuşu teorisi
Çok hücreli bir organizma içindeki yaşlanan hücreler, hücreler arasındaki rekabetle temizlenebilir, ancak bu kanser riskini artırır. Bu durum, her ikisi de yaşla birlikte artan ölüm oranlarına yol açan iki olasılık (fizyolojik olarak yararsız yaşlanan hücrelerin birikmesi ve kanser) arasında kaçınılmaz bir ikileme yol açmaktadır.[2]
Tek kullanımlık soma
Yaşlanmaya ilişkin tek kullanımlık soma teorisi 1977 yılında Thomas Kirkwood tarafından ortaya atılmıştır.[1][21] Teori, yaşlanmanın, bir bireyin sadece gerçekçi bir hayatta kalma şansı olduğu sürece somanın bakımına yatırım yaptığı bir strateji nedeniyle meydana geldiğini öne sürmektedir.[22] Kaynakları daha verimli kullanan bir tür daha uzun yaşayacak ve dolayısıyla genetik bilgiyi bir sonraki nesle aktarabilecektir. Üreme talepleri yüksektir, bu nedenle üreme ve türlerin hayatta kalmasına odaklanmak için germ hattı hücrelerine kıyasla somatik hücrelerin onarımı ve bakımı için daha az çaba harcanır.[23]
Programlanmış yaşlanma teorileri, yaşlanmanın adaptif olduğunu öne sürer ve normalde evrimleşebilirlik için seçilim veya grup seçilimine başvurur.
Üreme-hücre döngüsü teorisi, yaşlanmanın yaşam süresi boyunca hormonal sinyalizasyondaki değişikliklerle düzenlendiğini öne sürmektedir.[24]
Hasar birikimi teorileri
Yaşlanmanın serbest radikal teorisi
Yaşlanmaya ilişkin en önemli teorilerden biri ilk olarak 1956 yılında Harman tarafından ortaya atılmıştır.[25] Çözünmüş oksijen, radyasyon, hücresel solunum ve diğer kaynaklar tarafından üretilen serbest radikallerin hücredeki moleküler makinelere zarar verdiğini ve onları yavaş yavaş yıprattığını öne sürer. Bu aynı zamanda oksidatif stres olarak da bilinir.
Bu teoriyi destekleyen önemli kanıtlar vardır. Yaşlı hayvanlarda gençlere kıyasla daha fazla miktarda oksitlenmiş protein, DNA ve lipit bulunmaktadır.[26][27]
Kimyasal hasar

En eski yaşlanma teorilerinden biri, Raymond Pearl tarafından 1928 yılında (Max Rubner'in daha önceki çalışmalarına dayanarak) tanımlanan ve hızlı bazal metabolizma hızının kısa maksimum yaşam süresine karşılık geldiğini belirten yaşam oranı teorisiydi.[28]
Aşağıda ayrıntıları verilen ve metabolizmanın yan ürünleri olan çeşitli spesifik hasar türleri için, diğer her şey eşit olduğunda, hızlı bir metabolizmanın yaşam süresini azaltabileceği fikrinin bir miktar geçerliliği olsa da, genel olarak bu teori, türler içinde veya türler arasındaki yaşam süresi farklılıklarını yeterince açıklamamaktadır. Kalorisi kısıtlanmış hayvanlar, vücut kütlesinin gramı başına, ad libitum beslenen benzerleri kadar veya daha fazla kalori işlemekte, ancak önemli ölçüde daha uzun yaşam süreleri sergilemektedir.[] Benzer şekilde, metabolik hız, kuşlar, yarasalar ve diğer türler için yaşam süresinin zayıf bir belirleyicisidir; bu türlerin avlanma nedeniyle ölüm oranlarının azaldığı ve bu nedenle çok yüksek metabolik hızların varlığında bile uzun yaşam süreleri geliştirdikleri varsayılmaktadır.[29] 2007 yılında yapılan bir analizde, vücut büyüklüğü ve filogeninin etkilerini düzeltmek için modern istatistiksel yöntemler kullanıldığında, metabolik hızın memelilerde veya kuşlarda uzun ömür ile ilişkili olmadığı gösterilmiştir.[30]
Metabolizmanın neden olduğu belirli kimyasal hasar türleriyle ilgili olarak, oksijen ve şekerler gibi vücutta her yerde bulunan kimyasal ajanların neden olduğu yapısal proteinler veya DNA gibi uzun ömürlü biyopolimerlere verilen hasarın yaşlanmadan kısmen sorumlu olduğu öne sürülmektedir. Hasar, biyopolimer zincirlerinin kırılmasını, biyopolimerlerin çapraz bağlanmasını veya doğal olmayan sübstitüentlerin (haptenler) biyopolimerlere kimyasal olarak bağlanmasını içerebilir.[]
Normal aerobik koşullar altında, mitokondri tarafından metabolize edilen oksijenin yaklaşık %4'ü süperoksit iyonuna dönüştürülür, bu da daha sonra hidrojen peroksite, hidroksil radikaline ve nihayetinde diğer peroksitler ve tekli oksijen dahil olmak üzere diğer reaktif türlere dönüştürülebilir ve bunlar da yapısal proteinlere ve DNA'ya zarar verebilecek serbest radikaller oluşturabilir.[6]
Vücutta bulunan bakır ve demir gibi bazı metal iyonları da bu sürece katılabilir. (Vücudun bakır tutmasına neden olan kalıtsal bir kusur olan Wilson hastalığında, bazı semptomlar hızlandırılmış yaşlanmaya benzer). Oksidatif stres olarak adlandırılan bu süreçler, örneğin kahve[31] ve çayda[32] bulunan diyet polifenol antioksidanlarının potansiyel faydalarıyla bağlantılıdır. Bununla birlikte, tüketim orta düzeyde olduğunda yaşam süreleri üzerindeki tipik olumlu etkileri,[33][34][35] otofaji,[36] glikoz metabolizması[37] ve AMPK[38] üzerindeki etkilerle de açıklanmıştır.
Glukoz ve fruktoz gibi şekerler, lizin ve arjinin gibi belirli amino asitlerle ve guanin gibi belirli DNA bazlarıyla reaksiyona girerek glikasyon adı verilen bir süreçte şeker eklentileri üretebilir. Bu eklentiler daha sonra yapısal proteinleri veya DNA'yı benzer biyopolimerlere veya yapısal olmayan proteinler gibi diğer biyomoleküllere çapraz bağlayabilen reaktif türler oluşturmak üzere yeniden düzenlenebilir. Kan şekeri yüksek olan diyabetli kişilerde, yaşlanmayla ilişkili bozukluklar genel nüfusa göre çok daha erken ortaya çıkar, ancak kan şekeri seviyelerini titizlikle kontrol ederek bu tür bozuklukları geciktirebilirler. Şeker hasarının glikoksidasyon olarak adlandırılan bir süreçte oksidan hasarla bağlantılı olduğuna dair kanıtlar vardır.
Serbest radikaller proteinlere, lipitlere veya DNA'ya zarar verebilir. Glikasyon esas olarak proteinlere zarar verir. Hasarlı proteinler ve lipidler lizozomlarda lipofuscin olarak birikir. Yapısal proteinlerdeki kimyasal hasar işlev kaybına yol açabilir; örneğin, kan damarı duvarlarındaki kolajen hasarı damar duvarı sertliğine ve dolayısıyla hipertansiyona, damar duvarı kalınlaşmasına ve reaktif doku oluşumuna (ateroskleroz) yol açabilir; böbrekteki benzer süreçler böbrek yetmezliğine yol açabilir. Enzimlerin hasar görmesi hücresel işlevselliği azaltır. İç mitokondriyal membranın lipid peroksidasyonu elektrik potansiyelini ve enerji üretme kabiliyetini azaltır. "Hızlandırılmış yaşlanma hastalıkları" olarak adlandırılan hastalıkların neredeyse tamamının kusurlu DNA onarım enzimlerinden kaynaklanması muhtemelen tesadüf değildir.[39][40]
DNA hasarının yaşlanma fenotipinin neredeyse her yönüyle olan mekanik bağlantısı nedeniyle 2021 yılında yapılan bir incelemede DNA hasarının yaşlanmanın altında yatan neden olduğu öne sürülmüştür.[41] DNA metilasyonu ve birçok histon modifikasyonu gibi DNA hasarına bağlı epigenetik değişiklikler, yaşlanma süreci için özellikle önemli görünmektedir.[41] DNA hasarının yaşlanmanın temel nedeni olduğu teorisine ilişkin kanıtlar ilk kez 1981 yılında gözden geçirilmiştir.[42]
Alkolün yaşlanma üzerindeki etkisinin kısmen, alkolün glukokortikoid salgılanmasını uyaran HPA aksını aktive etmesiyle açıklanabileceğine ve uzun süreli maruziyetin yaşlanma semptomlarına yol açtığına inanılmaktadır.[43]
Mutasyon birikimi
Doğal seçilim, etkileri üremeden sonra hissediliyorsa ölümcül ve zararlı alelleri destekleyebilir. Genetikçi J. B. S. Haldane, Huntington hastalığına neden olan baskın mutasyonun neden popülasyonda kaldığını ve doğal seçilimin bunu neden ortadan kaldırmadığını merak etmiştir. Bu nörolojik hastalığın başlangıcı (ortalama olarak) 45 yaşındadır ve her zaman 10-20 yıl içinde ölümcüldür. Haldane, tarih öncesi insanlarda çok az kişinin 45 yaşına kadar hayatta kalabildiğini varsaymıştır. İleri yaşlarda çok az kişi hayatta olduğundan ve bu kişilerin bir sonraki nesle katkısı genç yaş gruplarındaki büyük kohortlara kıyasla küçük olduğundan, bu tür geç etkili zararlı mutasyonlara karşı seçilim gücü de buna bağlı olarak küçüktü. Bu nedenle, geç etkili zararlı mutasyonların genetik yükü, mutasyon-seçilim dengesinde önemli olabilir. Bu kavram seçilim gölgesi olarak bilinmektedir.[44]
Peter Medawar bu gözlemi yaşlanmaya ilişkin mutasyon birikimi teorisinde resmileştirmiştir.[45][46] "Doğal seçilimin gücü artan yaşla birlikte zayıflar - teorik olarak ölümsüz bir popülasyonda bile, yalnızca gerçek ölüm tehlikelerine maruz kalması koşuluyla. Eğer genetik bir felaket... bireysel yaşamda yeterince geç gerçekleşirse sonuçları tamamen önemsiz olabilir". 'Dışsal ölümlülük' olarak adlandırılan avlanma, hastalık ve kazalar gibi yaştan bağımsız tehlikeler, ihmal edilebilir yaşlanmaya sahip bir popülasyonda bile ileri yaş gruplarında daha az sayıda bireyin hayatta kalacağı anlamına gelir.
Diğer hasar
Bir çalışma, insan genomlarındaki retrovirüslerin uyku halinden uyanıp yaşlanmaya katkıda bulunabileceği ve bunun nötralize edici antikorlarla engellenerek "hücresel yaşlanma ve doku dejenerasyonunu ve bir dereceye kadar da organizma yaşlanmasını" hafifletebileceği sonucuna varmıştır.[47]
Yaşlanmaya ilişkin kök hücre teorileri
Yaşlanmanın kök hücre teorisi, yaşlanma sürecinin, çeşitli kök hücre türlerinin, bir organizmanın dokularını, o dokunun (veya organın) orijinal işlevini sürdürebilecek işlevsel farklılaşmış hücrelerle yenilemeye devam edememesinin bir sonucu olduğunu varsayar. Genetik materyalde hasar ve hata birikimi, hangi yaşta olursa olsun sistemler için her zaman bir sorundur. Gençlerde kök hücre sayısı yaşlılara oranla çok daha fazladır ve bu da yaşlıların aksine gençlerde daha iyi ve etkin bir yenileme mekanizması yaratır. Başka bir deyişle, yaşlanma hasarın artması değil, kök hücre sayısının azalması nedeniyle yerine yenisinin konulamaması meselesidir. Kök hücreler sayıca azalır ve döllere veya lenfoid soylara ve miyeloid soylara farklılaşma yeteneğini kaybetme eğilimindedir.
Kök hücre havuzlarının dinamik dengesini korumak çeşitli koşullar gerektirir. Hematopoetik kök hücrelerin homingi (Bkz. niş) ve kendini yenilemesiyle birlikte proliferasyon ve G0'ın dengelenmesi, kök hücre havuzunun korunmasını destekleyen unsurlar iken farklılaşma, mobilizasyon ve senesens zararlı unsurlardır. Bu zararlı etkiler sonunda apoptoza neden olacaktır.
Kök hücrelerin terapötik kullanımı ve organ ve dokuları yenileme kabiliyetleri söz konusu olduğunda da çeşitli zorluklar bulunmaktadır. İlk olarak, farklı hücreler aynı kök hücrelerden kaynaklansalar bile farklı yaşam sürelerine sahip olabilirler (Bkz. T-hücreleri ve eritrositler), bu da yaşlanmanın daha uzun yaşam süresine sahip hücrelerde daha kısa yaşam süresine sahip olanlara kıyasla farklı şekilde gerçekleşebileceği anlamına gelir. Ayrıca, somatik hücreleri değiştirmek için sürekli çaba göstermek kök hücrelerin tükenmesine neden olabilir.[48]
- Hematopoietik kök hücre yaşlanması
Hematopoetik kök hücreler (HKH'ler) yaşam boyunca kan sistemini yeniler ve homeostazı korur.[49] Yaşlanma sırasında uzun süreli HKH'lerde DNA iplikçik kırıkları birikir.[50][51] Bu birikim, DNA onarımı ve HKH sükunetine bağlı yanıt yollarının geniş ölçüde zayıflamasıyla ilişkilidir.[51] DNA ligaz 4 (Lig4), homolog olmayan uç birleştirme (HOUB) yoluyla çift iplikçik kırılmalarının onarımında oldukça spesifik bir role sahiptir. Farede Lig4 eksikliği yaşlanma sırasında HKH'lerde ilerleyici bir kayba neden olur.[52] Bu bulgular, HOUB'un HKH'lerin zaman içinde kendilerini koruma kabiliyetinin önemli bir belirleyicisi olduğunu göstermektedir.[52]
- Hematopoetik kök hücre çeşitliliği yaşlanması
Yapılan bir araştırma, kan hücrelerini üreten kök hücrelerin klonal çeşitliliğinin 70 yaş civarında büyük ölçüde azalarak daha hızlı büyüyen bir azınlığa dönüştüğünü göstererek, sağlıklı yaşlanmayı mümkün kılabilecek yeni bir yaşlanma teorisini doğruladı.[53][54]
- Hematopoetik mozaik Y kromozomu kaybı
2022 yılında yapılan bir çalışma, 'mozaik Y kromozomu kaybı' (mLOY) olarak adlandırılan ve 70 yaşındaki erkeklerin en az %40'ını bir dereceye kadar etkilediği bildirilen bir hücre alt kümesindeki kan hücrelerinin Y kromozomu kaybının, fibroz, kalp riskleri ve ölüm oranına nedensel bir şekilde katkıda bulunduğunu göstermiştir.[55][56]
Yaşlanmanın biyolojik belirteçleri
Eğer farklı bireyler farklı oranlarda yaşlanıyorsa o zaman doğurganlık, ölüm oranı ve işlevsel kapasite biyobelirteçler tarafından kronolojik yaştan daha iyi tahmin edilebilir.[57][58] Ancak saçların beyazlaması,[59] yüzün yaşlanması, cilt kırışıklıkları ve yaşlanmayla birlikte görülen diğer yaygın değişiklikler, gelecekteki işlevselliğin kronolojik yaştan daha iyi göstergeleri değildir. Biyogerontologlar yaşlanmanın biyobelirteçlerini bulma ve doğrulama çabalarını sürdürmektedirler, ancak şimdiye kadarki başarı sınırlı olmuştur.
CD4 ve CD8 hafıza T hücreleri ve naif T hücrelerinin seviyeleri, orta yaşlı farelerin beklenen yaşam süresine ilişkin iyi tahminler vermek için kullanılmıştır.[60]
Yaşlanma saatleri
İnsanın kronolojik yaşını tahmin etme kabiliyetine dayalı olarak, yaşlanmanın bir biyobelirteci olarak epigenetik saate ilgi vardır.[61] Temel kan biyokimyası ve hücre sayımları da kronolojik yaşı doğru bir şekilde tahmin etmek için kullanılabilir.[62] Transkriptomik yaşlanma saatlerini kullanarak insanın kronolojik yaşını tahmin etmek de mümkündür.[63]
Farklı dokuların veya sistemlerin ya da genel olarak biyolojik yaşı ölçmek için başka biyobelirteçler, tespit sistemleri ve yazılım sistemleri araştırılmakta ve geliştirilmektedir. Örneğin, anatomik manyetik rezonans görüntülerini kullanan bir derin öğrenme (DL) yazılımı, Alzheimer hastalığının erken belirtilerini ve nörolojik yaşlanmanın değişen nöroanatomik modellerini tespit etmek de dahil olmak üzere beyin yaşını nispeten yüksek doğrulukla tahmin etmiştir[64] ve bir DL aracının, sistemik yaşa bağlı iltihaplanma modellerine dayalı olarak bir kişinin iltihaplanma yaşını hesapladığı bildirilmiştir.[65]
Yaşlanma saatleri, kombinasyon tedavileri de dahil olmak üzere müdahalelerin insanlar üzerindeki etkilerini değerlendirmek için kullanılmıştır.[66]
Yaşlanmanın genetik belirleyicileri
Yaşlanmanın bir dizi genetik bileşeni, basit tomurcuklanan maya Saccharomyces cerevisiae'den meyve sinekleri (Drosophila melanogaster) ve Caenorhabditis elegans gibi solucanlara kadar değişen model organizmalar kullanılarak tanımlanmıştır. Bu organizmaların incelenmesi, en az iki korunmuş yaşlanma yolunun varlığını ortaya çıkarmıştır.
Gen ifadesi kusurlu bir şekilde kontrol edilir ve mayada bu tür genler üzerinde yapılan bir çalışmada önerildiği gibi, birçok genin ifade seviyelerindeki rastgele dalgalanmaların yaşlanma sürecine katkıda bulunması mümkündür.[67] Genetik olarak aynı olan bireysel hücreler, yine de dış uyaranlara önemli ölçüde farklı tepkiler verebilir ve belirgin şekilde farklı yaşam sürelerine sahip olabilir, bu da genetik faktörlerin yanı sıra epigenetik faktörlerin de gen ifadesi ve yaşlanmada önemli bir rol oynadığını gösterir. Yaşlanmanın epigenetiği üzerine araştırmalar vardır.
DNA çift sarmal kırıklarını onarma yeteneği, farelerde[68] ve insanlarda[69] yaşlanmayla birlikte azalır.
Her biri progeria olarak adlandırılan bir dizi nadir kalıtsal (genetik) bozukluk bir süredir bilinmektedir. Hastalar, kırışmış cilt de dahil olmak üzere hızlandırılmış yaşlanmaya benzeyen semptomlar sergilerler. Hutchinson-Gilford progeria sendromunun nedeni Mayıs 2003'te Nature dergisinde rapor edilmiştir.[70] Bu rapor, hızlandırılmış yaşlanmanın bu türünün nedeninin oksidatif stres değil DNA hasarı olduğunu öne sürmektedir.
Bir çalışma, yaşlanmanın aktiviteyi kısa genlere veya daha kısa transkript uzunluğuna doğru kaydırabileceğini ve bunun müdahalelerle önlenebileceğini göstermektedir.[71]
Toplumda sağlık süreleri ve yaşlanma


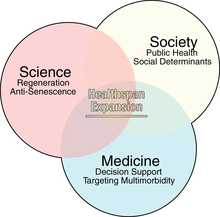
Sağlık süresi genel olarak, kişinin yaşamının sağlıklı olduğu, örneğin önemli hastalıkların[73] veya kapasitelerde (örneğin duyular, kas, dayanıklılık ve biliş) düşüşlerin olmadığı dönem olarak tanımlanabilir.
Nüfusun yaşlanmasıyla birlikte, yaşa bağlı hastalıklarda artış görülmekte ve bu da sağlık sistemlerinin yanı sıra çağdaş ekonomiler veya çağdaş ekonomi ve bunlara bağlı toplumsal sistemler üzerinde büyük yükler oluşturmaktadır. Sağlık süresini uzatma ve yaşlanma karşıtı araştırmalar, yaşlıların sağlık süresini uzatmanın yanı sıra yaşlanmayı veya fiziksel ve zihinsel gerileme gibi olumsuz etkilerini yavaşlatmayı amaçlamaktadır. Modern yaşlanma karşıtı ve rejeneratif teknolojiler, artırılmış karar verme mekanizmalarıyla birlikte "adil bir küresel refah geleceği için sağlık-ömür boşluğunu sorumlu bir şekilde kapatmaya" yardımcı olabilir.[74] Yaşlanma "kronik hastalık, kırılganlık ve engellilik için en yaygın risk faktörüdür ve 2050 yılına kadar 60 yaş üstü 2 milyardan fazla insan olacağı tahmin edilmektedir", bu da onu doğuştan gelen yaşlanma sürecini değiştiren ve hedefleyen müdahaleler de dahil olmak üzere önemli (ve iyi düzenlenmiş veya verimli) çabalar gerektiren büyük bir küresel sağlık sorunu haline getirmektedir.[75]
Biyolojik yaşlanma veya LHG, potansiyel olarak artan sağlık bakım maliyetleri de dahil olmak üzere (tedavi türlerine ve maliyetlerine de bağlı olarak) toplum için büyük bir maliyet yükü getirmektedir.[72][76] Bu durum, küresel yaşam kalitesi veya refah ile birlikte, sağlık sürelerinin uzatılmasının önemini vurgulamaktadır.[72]
Yaşam süresini uzatabilecek pek çok önlem aynı zamanda sağlık süresini de uzatabilir, ancak durum her zaman böyle olmayabilir, bu da ilgili araştırmalarda "yaşam süresinin artık tek ilgi parametresi olamayacağını" göstermektedir.[77] Son dönemdeki yaşam beklentisi artışlarını "paralel" bir sağlık süresi genişlemesi takip etmemiş olsa da[72] 2017 itibarıyla sağlık süresi kavramına ve konularına ilişkin farkındalık oldukça düşüktür.[73] Bilim insanları, "yaşlanmaya bağlı kronik hastalıkların giderek arttığını ve insanların yaşam kalitesine anlatılamaz maliyetler yüklediğini" belirtmiştir.[76]
Müdahaleler
Yaşam uzatma, tıptaki gelişmeler yoluyla mütevazı bir şekilde ya da maksimum yaşam süresini genel olarak belirlenmiş sınır olan 125 yılın ötesine çıkararak insan ömrünü uzatma kavramıdır.[78] "Yaşam uzatmacılar", "ölümsüzcüler" (daha uzun bir yaşam elde etmek isteyenler) ile birlikte bu alandaki bazı araştırmacılar, doku gençleştirme, kök hücreler, rejeneratif tıp, moleküler onarım, gen terapisi, farmasötikler ve organ replasmanı (yapay organlar ya da ksenotransplantasyonlar gibi) alanlarında gelecekte gerçekleştirilecek atılımların, sonunda insanların sağlıklı bir gençlik durumuna tam gençleşme yoluyla belirsiz yaşam sürelerine (agerasia[79]) sahip olmalarını sağlayacağını varsaymaktadır. Yaşam süresinin uzatılmasının mümkün olması halinde ortaya çıkacak etik sonuçlar biyoetikçiler tarafından tartışılmaktadır.
Takviyeler ve hormon replasmanı gibi yaşlanma karşıtı olduğu iddia edilen ürünlerin satışı kazançlı bir küresel endüstridir. Örneğin, ABD pazarında tüketicilerin yaşlanma sürecini yavaşlatmak veya tersine çevirmek için hormon kullanımını teşvik eden endüstri, 2009 yılında yılda yaklaşık 50 milyar dolar gelir elde etmiştir.[80] Bu tür hormon ürünlerinin kullanımının etkili ya da güvenli olduğu kanıtlanmamıştır.[80][81][82][83]
Ayrıca bakınız
- Demans
- DNA onarımı
- Yaşlılık hekimliği
- Gerontoloji
- Ağır metal
- Ölümsüzlük
- İleri yaş
- Fenoptozis
- Programlanmış hücre ölümü
Kaynakça
- ^ a b Kirkwood, T. B. L. (1977). "Evolution of ageing". Nature. 270 (5635): 301-304. Bibcode:1977Natur.270..301K. doi:10.1038/270301a0. ISSN 0028-0836. PMID 593350. 15 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ a b Nelson P, Masel J (December 2017). "Intercellular competition and the inevitability of multicellular aging". Proceedings of the National Academy of Sciences of the United States of America. 114 (49): 12982-12987. Bibcode:2017PNAS..11412982N. doi:10.1073/pnas.1618854114. PMC 5724245 $2. PMID 29087299.
- ^ "Aging and Gerontology Glossary". 19 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Şubat 2011.
- ^ López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G (June 2013). "The hallmarks of aging". Cell. 153 (6): 1194-217. doi:10.1016/j.cell.2013.05.039. PMC 3836174 $2. PMID 23746838.
- ^ López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (19 Ocak 2023). "Hallmarks of aging: An expanding universe". Cell (İngilizce). 186 (2): 243-278. doi:10.1016/j.cell.2022.11.001. ISSN 0092-8674. PMID 36599349. 17 Şubat 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Şubat 2023.
- ^ a b Holmes GE, Bernstein C, Bernstein H (September 1992). "Oxidative and other DNA damages as the basis of aging: a review". Mutat. Res. 275 (3–6): 305-15. doi:10.1016/0921-8734(92)90034-m. PMID 1383772.
- ^ a b Williams GC (1957). "Pleiotropy, natural selection, and the evolution of senescence". Evolution. 11 (4): 398-411. doi:10.2307/2406060. JSTOR 2406060.
- ^ Austad SN (February 2009). "Comparative biology of aging". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 64 (2): 199-201. doi:10.1093/gerona/gln060. PMC 2655036 $2. PMID 19223603.
- ^ Wang L, Cui J, Jin B, Zhao J, Xu H, Lu Z, Li W, Li X, Li L, Liang E, Rao X, Wang S, Fu C, Cao F, Dixon RA, Lin J (January 2020). "Multifeature analyses of vascular cambial cells reveal longevity mechanisms in old Ginkgo biloba trees". Proceedings of the National Academy of Sciences of the United States of America. 117 (4): 2201-2210. Bibcode:2020PNAS..117.2201W. doi:10.1073/pnas.1916548117. PMC 6995005 $2. PMID 31932448.
- ^ Ackermann M, Stearns SC, Jenal U (June 2003). "Senescence in a bacterium with asymmetric division". Science. 300 (5627): 1920. doi:10.1126/science.1083532. PMID 12817142.
- ^ Stewart EJ, Madden R, Paul G, Taddei F (February 2005). "Aging and death in an organism that reproduces by morphologically symmetric division". PLOS Biology. 3 (2): e45. doi:10.1371/journal.pbio.0030045. PMC 546039 $2. PMID 15685293.
- ^ Dańko MJ, Kozłowski J, Schaible R (October 2015). "Unraveling the non-senescence phenomenon in Hydra". Journal of Theoretical Biology. 382: 137-49. Bibcode:2015JThBi.382..137D. doi:10.1016/j.jtbi.2015.06.043. PMID 26163368.
- ^ Tan TC, Rahman R, Jaber-Hijazi F, Felix DA, Chen C, Louis EJ, Aboobaker A (March 2012). "Telomere maintenance and telomerase activity are differentially regulated in asexual and sexual worms". Proceedings of the National Academy of Sciences of the United States of America. 109 (11): 4209-14. Bibcode:2012PNAS..109.4209T. doi:10.1073/pnas.1118885109. PMC 3306686 $2. PMID 22371573.
- ^ Lisenkova AA, Grigorenko AP, Tyazhelova TV, Andreeva TV, Gusev FE, Manakhov AD, Goltsov AY, Piraino S, Miglietta MP, Rogaev EI (February 2017). "Complete mitochondrial genome and evolutionary analysis of Turritopsis dohrnii, the "immortal" jellyfish with a reversible life-cycle". Molecular Phylogenetics and Evolution. 107: 232-238. doi:10.1016/j.ympev.2016.11.007. PMID 27845203.
- ^ Piraino S, Boero F, Aeschbach B, Schmid V (June 1996). "Reversing the Life Cycle: Medusae Transforming into Polyps and Cell Transdifferentiation in Turritopsis nutricula (Cnidaria, Hydrozoa)". The Biological Bulletin. 190 (3): 302-312. doi:10.2307/1543022. JSTOR 1543022. PMID 29227703.
- ^ Vaupel JW, Baudisch A, Dölling M, Roach DA, Gampe J (June 2004). "The case for negative senescence". Theoretical Population Biology. 65 (4): 339-51. doi:10.1016/j.tpb.2003.12.003. PMID 15136009.
- ^ Viña J, Borrás C, Miquel J (2007). "Theories of ageing". IUBMB Life. 59 (4–5): 249-54. doi:10.1080/15216540601178067. PMID 17505961.
- ^ Kirkwood, Thomas B. L.; Austad, Steven N. (2000). "Why do we age?". Nature. 408 (6809): 233-238. Bibcode:2000Natur.408..233K. doi:10.1038/35041682. ISSN 0028-0836. PMID 11089980. 15 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Medawar, Peter Brian, Sir (1952). An unsolved problem of biology. Published for the College by H. K. Lewis & Co. Ltd. OCLC 869293719. 15 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Rose, Michael R. (1991). Evolutionary biology of aging. Oxford University Press. ISBN 1-4237-6520-6. OCLC 228167629. 15 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Kirkwood, Tom (2006). Time of Our Lives : the Science of Human Aging. Oxford University Press. ISBN 978-0-19-802939-7. OCLC 437175125. 15 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Hammers M, Richardson DS, Burke T, Komdeur J (September 2013). "The impact of reproductive investment and early-life environmental conditions on senescence: support for the disposable soma hypothesis". Journal of Evolutionary Biology. 26 (9): 1999-2007. doi:10.1111/jeb.12204. hdl:11370/9cc6749c-f67d-40ab-a253-a06650c32102. PMID 23961923.
- ^ Kirkwood TB, Rose MR (April 1991). "Evolution of senescence: late survival sacrificed for reproduction". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 332 (1262): 15-24. Bibcode:1991RSPTB.332...15K. doi:10.1098/rstb.1991.0028. PMID 1677205.
- ^ Atwood CS, Bowen RL (2011). "The reproductive-cell cycle theory of aging: an update". Experimental Gerontology. 46 (2–3): 100-7. doi:10.1016/j.exger.2010.09.007. PMID 20851172.
- ^ Harman D (July 1956). "Aging: a theory based on free radical and radiation chemistry". Journal of Gerontology. 11 (3): 298-300. doi:10.1093/geronj/11.3.298. PMID 13332224.
- ^ Stadtman ER (August 1992). "Protein oxidation and aging". Science. 257 (5074): 1220-4. Bibcode:1992Sci...257.1220S. doi:10.1126/science.1355616. PMID 1355616. 31 Temmuz 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Sohal RS, Agarwal S, Dubey A, Orr WC (August 1993). "Protein oxidative damage is associated with life expectancy of houseflies". Proceedings of the National Academy of Sciences of the United States of America. 90 (15): 7255-9. Bibcode:1993PNAS...90.7255S. doi:10.1073/pnas.90.15.7255. PMC 47115 $2. PMID 8346242.
- ^ Pearl R (1928). The Rate of Living, Being an Account of Some Experimental Studies on the Biology of Life Duration. New York: Alfred A. Knopf.[]
- ^ Brunet-Rossinni AK, Austad SN (2004). "Ageing studies on bats: a review". Biogerontology. 5 (4): 211-22. doi:10.1023/B:BGEN.0000038022.65024.d8. PMID 15314271.
- ^ de Magalhães JP, Costa J, Church GM (February 2007). "An analysis of the relationship between metabolism, developmental schedules, and longevity using phylogenetic independent contrasts". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 62 (2): 149-60. CiteSeerX 10.1.1.596.2815 $2. doi:10.1093/gerona/62.2.149. PMC 2288695 $2. PMID 17339640.
- ^ Freedman ND, Park Y, Abnet CC, Hollenbeck AR, Sinha R (May 2012). "Association of coffee drinking with total and cause-specific mortality". The New England Journal of Medicine. 366 (20): 1891-904. doi:10.1056/NEJMoa1112010. PMC 3439152 $2. PMID 22591295.
- ^ Yang Y, Chan SW, Hu M, Walden R, Tomlinson B (2011). "Effects of some common food constituents on cardiovascular disease". ISRN Cardiology. 2011: 397136. doi:10.5402/2011/397136. PMC 3262529 $2. PMID 22347642.
- ^ Poole, Robin; Kennedy, Oliver J.; Roderick, Paul; Fallowfield, Jonathan A.; Hayes, Peter C.; Parkes, Julie (22 Kasım 2017). "Coffee consumption and health: umbrella review of meta-analyses of multiple health outcomes". BMJ (İngilizce). 359: j5024. doi:10.1136/bmj.j5024. ISSN 0959-8138. PMC 5696634 $2. PMID 29167102.
- ^ O'Keefe, James H.; DiNicolantonio, James J.; Lavie, Carl J. (1 Mayıs 2018). "Coffee for Cardioprotection and Longevity". Progress in Cardiovascular Diseases (İngilizce). 61 (1): 38-42. doi:10.1016/j.pcad.2018.02.002. ISSN 0033-0620. PMID 29474816.
- ^ Grosso, Giuseppe; Godos, Justyna; Galvano, Fabio; Giovannucci, Edward L. (21 Ağustos 2017). "Coffee, Caffeine, and Health Outcomes: An Umbrella Review". Annual Review of Nutrition (İngilizce). 37 (1): 131-156. doi:10.1146/annurev-nutr-071816-064941. ISSN 0199-9885. PMID 28826374.
- ^ Dirks-Naylor, Amie J. (15 Aralık 2015). "The benefits of coffee on skeletal muscle". Life Sciences (İngilizce). 143: 182-186. doi:10.1016/j.lfs.2015.11.005. ISSN 0024-3205. PMID 26546720.
- ^ Reis, Caio E. G.; Dórea, José G.; da Costa, Teresa H. M. (1 Temmuz 2019). "Effects of coffee consumption on glucose metabolism: A systematic review of clinical trials". Journal of Traditional and Complementary Medicine (İngilizce). 9 (3): 184-191. doi:10.1016/j.jtcme.2018.01.001. ISSN 2225-4110. PMC 6544578 $2. PMID 31193893.
- ^ Loureiro, Laís Monteiro Rodrigues; Reis, Caio Eduardo Gonçalves; Costa, Teresa Helena Macedo da (1 Mayıs 2018). "Effects of Coffee Components on Muscle Glycogen Recovery: A Systematic Review". International Journal of Sport Nutrition and Exercise Metabolism (İngilizce). 28 (3): 284-293. doi:10.1123/ijsnem.2017-0342. ISSN 1543-2742. PMID 29345166.
- ^ Bernstein H, Payne CM, Bernstein C, Garewal H, Dvorak K (2008). "Cancer and aging as consequences of un-repaired DNA damage.". Kimura H, Suzuki A (Ed.). New Research on DNA Damage. Nova Science Publishers. ss. 1-47. ISBN 978-1604565812. 15 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Pan MR, Li K, Lin SY, Hung WC (May 2016). "Connecting the Dots: From DNA Damage and Repair to Aging". International Journal of Molecular Sciences. 17 (5): 685. doi:10.3390/ijms17050685. PMC 4881511 $2. PMID 27164092.
- ^ a b Schumacher, Björn; Pothof, Joris; Vijg, Jan; Hoeijmakers, Jan H. J. (Nisan 2021). "The central role of DNA damage in the ageing process". Nature. 592 (7856): 695-703. doi:10.1038/s41586-021-03307-7. ISSN 1476-4687. PMC 9844150 $2. PMID 33911272. 4 Ağustos 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Gensler, H. L.; Bernstein, H. (Eylül 1981). "DNA damage as the primary cause of aging". The Quarterly Review of Biology. 56 (3): 279-303. doi:10.1086/412317. ISSN 0033-5770. PMID 7031747. 28 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Spencer RL, Hutchison KE (1999). "Alcohol, aging, and the stress response" (PDF). Alcohol Research & Health. 23 (4): 272-83. PMC 6760387 $2. PMID 10890824. 11 Aralık 2018 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Fabian D, Flatt T (2011). "The Evolution of Aging". Scitable. Nature Publishing Group. 31 Mart 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Medawar PB (1946). "Old age and natural death". Modern Quarterly. 1: 30-56.
- ^ Medawar PB (1952). An Unsolved Problem of Biology. Londra: H. K. Lewis & Co. Ltd.[]
- ^ Liu, Xiaoqian; Liu, Zunpeng; Wu, Zeming; Ren, Jie; Fan, Yanling; Sun, Liang; Cao, Gang; Niu, Yuyu; Zhang, Baohu; Ji, Qianzhao; Jiang, Xiaoyu; Wang, Cui; Wang, Qiaoran; Ji, Zhejun; Li, Lanzhu; Esteban, Concepcion Rodriguez; Yan, Kaowen; Li, Wei; Cai, Yusheng; Wang, Si; Zheng, Aihua; Zhang, Yong E.; Tan, Shengjun; Cai, Yingao; Song, Moshi; Lu, Falong; Tang, Fuchou; Ji, Weizhi; Zhou, Qi; Belmonte, Juan Carlos Izpisua; Zhang, Weiqi; Qu, Jing; Liu, Guang-Hui (19 Ocak 2023). "Resurrection of endogenous retroviruses during aging reinforces senescence". Cell (İngilizce). 186 (2): 287-304.e26. doi:10.1016/j.cell.2022.12.017. ISSN 0092-8674. PMID 36610399.
- ^ Smith J., A., Daniel R. "Stem Cells and Aging: A Chicken-Or-Egg Issue?". Aging and Disease. 2012 Jun, Vol. 3, Number 3; 260–268.
- ^ Mahla RS (2016). "Stem cells application in regenerative medicine and disease threpeutics". International Journal of Cell Biology. 2016 (7): 19. doi:10.1155/2016/6940283. PMC 4969512 $2. PMID 27516776.
- ^ Rossi DJ, Bryder D, Seita J, Nussenzweig A, Hoeijmakers J, Weissman IL (2007). "Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age". Nature. 447 (7145): 725-9. Bibcode:2007Natur.447..725R. doi:10.1038/nature05862. PMID 17554309.
- ^ a b Beerman I, Seita J, Inlay MA, Weissman IL, Rossi DJ (2014). "Quiescent hematopoietic stem cells accumulate DNA damage during aging that is repaired upon entry into cell cycle". Cell Stem Cell. 15 (1): 37-50. doi:10.1016/j.stem.2014.04.016. PMC 4082747 $2. PMID 24813857.
- ^ a b Nijnik A, Woodbine L, Marchetti C, Dawson S, Lambe T, Liu C, Rodrigues NP, Crockford TL, Cabuy E, Vindigni A, Enver T, Bell JI, Slijepcevic P, Goodnow CC, Jeggo PA, Cornall RJ (2007). "DNA repair is limiting for haematopoietic stem cells during ageing". Nature. 447 (7145): 686-90. Bibcode:2007Natur.447..686N. doi:10.1038/nature05875. PMID 17554302.
- ^ "Research may reveal why people can suddenly become frail in their 70s". The Guardian (İngilizce). 1 Haziran 2022. 18 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Temmuz 2022.
- ^ Mitchell, Emily; Spencer Chapman, Michael; Williams, Nicholas; Dawson, Kevin J.; Mende, Nicole; Calderbank, Emily F.; Jung, Hyunchul; Mitchell, Thomas; Coorens, Tim H. H.; Spencer, David H.; Machado, Heather; Lee-Six, Henry; Davies, Megan; Hayler, Daniel; Fabre, Margarete A.; Mahbubani, Krishnaa; Abascal, Federico; Cagan, Alex; Vassiliou, George S.; Baxter, Joanna; Martincorena, Inigo; Stratton, Michael R.; Kent, David G.; Chatterjee, Krishna; Parsy, Kourosh Saeb; Green, Anthony R.; Nangalia, Jyoti; Laurenti, Elisa; Campbell, Peter J. (June 2022). "Clonal dynamics of haematopoiesis across the human lifespan". Nature (İngilizce). 606 (7913): 343-350. Bibcode:2022Natur.606..343M. doi:10.1038/s41586-022-04786-y. ISSN 1476-4687. PMC 9177428 $2. PMID 35650442.
- ^ Kolata, Gina (14 Temmuz 2022). "As Y Chromosomes Vanish With Age, Heart Risks May Grow". The New York Times. 21 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Ağustos 2022.
- ^ Sano, Soichi; Horitani, Keita; Ogawa, Hayato; Halvardson, Jonatan; Chavkin, Nicholas W.; Wang, Ying; Sano, Miho; Mattisson, Jonas; Hata, Atsushi; Danielsson, Marcus; Miura-Yura, Emiri; Zaghlool, Ammar; Evans, Megan A.; Fall, Tove; De Hoyos, Henry N.; Sundström, Johan; Yura, Yoshimitsu; Kour, Anupreet; Arai, Yohei; Thel, Mark C.; Arai, Yuka; Mychaleckyj, Josyf C.; Hirschi, Karen K.; Forsberg, Lars A.; Walsh, Kenneth (15 Temmuz 2022). "Hematopoietic loss of Y chromosome leads to cardiac fibrosis and heart failure mortality". Science (İngilizce). 377 (6603): 292-297. Bibcode:2022Sci...377..292S. doi:10.1126/science.abn3100. ISSN 0036-8075. PMC 9437978 $2. PMID 35857592.
- ^ Gasmi A, Chirumbolo S, Peana M, Mujawdiya PK, Dadar M, Menzel A, Bjørklund G (17 Eylül 2020). "Biomarkers of Senescence during Aging as Possible Warnings to Use Preventive Measures". Current Medicinal Chemistry. 28 (8): 1471-1488. doi:10.2174/0929867327999200917150652. PMID 32942969.
- ^ Baker GT, Sprott RL (1988). "Biomarkers of aging". Experimental Gerontology. 23 (4–5): 223-39. doi:10.1016/0531-5565(88)90025-3. PMID 3058488. 24 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Van Neste D, Tobin DJ (2004). "Hair cycle and hair pigmentation: dynamic interactions and changes associated with aging". Micron. 35 (3): 193-200. doi:10.1016/j.micron.2003.11.006. PMID 15036274.
- ^ Miller RA (April 2001). "Biomarkers of aging: prediction of longevity by using age-sensitive T-cell subset determinations in a middle-aged, genetically heterogeneous mouse population". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 56 (4): B180-6. doi:10.1093/gerona/56.4.b180. PMC 7537444 $2. PMID 11283189.
- ^ Horvath S (2013). "DNA methylation age of human tissues and cell types". Genome Biology. 14 (10): R115. doi:10.1186/gb-2013-14-10-r115. PMC 4015143 $2. PMID 24138928.
- ^ Putin E, Mamoshina P, Aliper A, Korzinkin M, Moskalev A, Kolosov A, Ostrovskiy A, Cantor C, Vijg J, Zhavoronkov A (May 2016). "Deep biomarkers of human aging: Application of deep neural networks to biomarker development". Aging. 8 (5): 1021-33. doi:10.18632/aging.100968. PMC 4931851 $2. PMID 27191382.
- ^ Peters MJ, Joehanes R, Pilling LC, Schurmann C, Conneely KN, Powell J, Reinmaa E, Sutphin GL, Zhernakova A, Schramm K, Wilson YA, Kobes S, Tukiainen T, Ramos YF, Göring HH, Fornage M, Liu Y, Gharib SA, Stranger BE, De Jager PL, Aviv A, Levy D, Murabito JM, Munson PJ, Huan T, Hofman A, Uitterlinden AG, Rivadeneira F, van Rooij J, Stolk L, Broer L, Verbiest MM, Jhamai M, Arp P, Metspalu A, Tserel L, Milani L, Samani NJ, Peterson P, Kasela S, Codd V, Peters A, Ward-Caviness CK, Herder C, Waldenberger M, Roden M, Singmann P, Zeilinger S, Illig T, Homuth G, Grabe HJ, Völzke H, Steil L, Kocher T, Murray A, Melzer D, Yaghootkar H, Bandinelli S, Moses EK, Kent JW, Curran JE, Johnson MP, Williams-Blangero S, Westra HJ, McRae AF, Smith JA, Kardia SL, Hovatta I, Perola M, Ripatti S, Salomaa V, Henders AK, Martin NG, Smith AK, Mehta D, Binder EB, Nylocks KM, Kennedy EM, Klengel T, Ding J, Suchy-Dicey AM, Enquobahrie DA, Brody J, Rotter JI, Chen YD, Houwing-Duistermaat J, Kloppenburg M, Slagboom PE, Helmer Q, den Hollander W, Bean S, Raj T, Bakhshi N, Wang QP, Oyston LJ, Psaty BM, Tracy RP, Montgomery GW, Turner ST, Blangero J, Meulenbelt I, Ressler KJ, Yang J, Franke L, Kettunen J, Visscher PM, Neely GG, Korstanje R, Hanson RL, Prokisch H, Ferrucci L, Esko T, Teumer A, van Meurs JB, Johnson AD (October 2015). "The transcriptional landscape of age in human peripheral blood". Nature Communications. 6: 8570. Bibcode:2015NatCo...6.8570.. doi:10.1038/ncomms9570. PMC 4639797 $2. PMID 26490707.
- ^ Yin, Chenzhong; Imms, Phoebe; Cheng, Mingxi (10 Ocak 2023). "Anatomically interpretable deep learning of brain age captures domain-specific cognitive impairment". Proceedings of the National Academy of Sciences (İngilizce). 120 (2): e2214634120. Bibcode:2023PNAS..12014634Y. doi:10.1073/pnas.2214634120. ISSN 0027-8424. PMC 9926270 $2. PMID 36595679.
- ^ Sayed, Nazish; Huang, Yingxiang; Nguyen, Khiem; Krejciova-Rajaniemi, Zuzana; Grawe, Anissa P.; Gao, Tianxiang; Tibshirani, Robert; Hastie, Trevor; Alpert, Ayelet; Cui, Lu; Kuznetsova, Tatiana; Rosenberg-Hasson, Yael; Ostan, Rita; Monti, Daniela; Lehallier, Benoit; Shen-Orr, Shai S.; Maecker, Holden T.; Dekker, Cornelia L.; Wyss-Coray, Tony; Franceschi, Claudio; Jojic, Vladimir; Haddad, François; Montoya, José G.; Wu, Joseph C.; Davis, Mark M.; Furman, David (July 2021). "An inflammatory aging clock (iAge) based on deep learning tracks multimorbidity, immunosenescence, frailty and cardiovascular aging". Nature Aging (İngilizce). 1 (7): 598-615. doi:10.1038/s43587-021-00082-y. ISSN 2662-8465. PMC 8654267 $2. PMID 34888528.
- ^ Fitzgerald, K. N.; Hodges, R.; Hanes, D.; Stack, E.; Cheishvili, D.; Szyf, M.; Henkel, J.; Twedt, M. W.; Giannopoulou, D.; Herdell, J.; Logan, S.; Bradley, R. (2021). "Potential reversal of epigenetic age using a diet and lifestyle intervention: a pilot randomized clinical trial". Aging. 13 (7): 9419-9432. doi:10.18632/aging.202913. PMC 8064200 $2. PMID 33844651. 2 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Haziran 2021.
- ^ Ryley J, Pereira-Smith OM (2006). "Microfluidics device for single cell gene expression analysis in Saccharomyces cerevisiae". Yeast. 23 (14–15): 1065-73. doi:10.1002/yea.1412. PMID 17083143.
- ^ Vaidya A, Mao Z, Tian X, Spencer B, Seluanov A, Gorbunova V (July 2014). "Knock-in reporter mice demonstrate that DNA repair by non-homologous end joining declines with age". PLOS Genet. 10 (7): e1004511. doi:10.1371/journal.pgen.1004511. PMC 4102425 $2. PMID 25033455.
- ^ Li Z, Zhang W, Chen Y, Guo W, Zhang J, Tang H, Xu Z, Zhang H, Tao Y, Wang F, Jiang Y, Sun FL, Mao Z (November 2016). "Impaired DNA double-strand break repair contributes to the age-associated rise of genomic instability in humans". Cell Death Differ. 23 (11): 1765-77. doi:10.1038/cdd.2016.65. PMC 5071568 $2. PMID 27391797.
- ^ Mounkes LC, Kozlov S, Hernandez L, Sullivan T, Stewart CL (May 2003). "A progeroid syndrome in mice is caused by defects in A-type lamins". Nature. 423 (6937): 298-301. Bibcode:2003Natur.423..298M. doi:10.1038/nature01631. PMID 12748643. 30 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2023.
- ^ Stoeger, Thomas; Grant, Rogan A.; McQuattie-Pimentel, Alexandra C.; Anekalla, Kishore R.; Liu, Sophia S.; Tejedor-Navarro, Heliodoro; Singer, Benjamin D.; Abdala-Valencia, Hiam; Schwake, Michael; Tetreault, Marie-Pier; Perlman, Harris; Balch, William E.; Chandel, Navdeep S.; Ridge, Karen M.; Sznajder, Jacob I.; Morimoto, Richard I.; Misharin, Alexander V.; Budinger, G. R. Scott; Nunes Amaral, Luis A. (December 2022). "Aging is associated with a systemic length-associated transcriptome imbalance". Nature Aging (İngilizce). 2 (12): 1191-1206. doi:10.1038/s43587-022-00317-6. ISSN 2662-8465. PMC 10154227 $2. PMID 37118543.
- ^ a b c d e f Garmany, Armin; Yamada, Satsuki; Terzic, Andre (23 Eylül 2021). "Longevity leap: mind the healthspan gap". npj Regenerative Medicine (İngilizce). 6 (1): 57. doi:10.1038/s41536-021-00169-5. ISSN 2057-3995. PMC 8460831 $2. PMID 34556664.
- ^ a b "Healthspan is more important than lifespan, so why don't more people know about it? | Institute for Public Health | Washington University in St. Louis". publichealth.wustl.edu. 1 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Mart 2023.
- ^ Garmany A, Yamada S, Terzic A (September 2021). "Longevity leap: mind the healthspan gap". npj Regenerative Medicine. 6 (1): 57. doi:10.1038/s41536-021-00169-5. PMC 8460831 $2. PMID 34556664.
- ^ Farrelly C (November 2022). "Aging, Equality and the Human Healthspan". HEC Forum: 1-19. doi:10.1007/s10730-022-09499-3. PMC 9644010 $2. PMID 36348214.
- ^ a b Hansen, Malene; Kennedy, Brian K. (1 Ağustos 2016). "Does Longer Lifespan Mean Longer Healthspan?". Trends in Cell Biology (İngilizce). 26 (8): 565-568. doi:10.1016/j.tcb.2016.05.002. ISSN 0962-8924. PMC 4969078 $2. PMID 27238421.
- ^ Bansal, Ankita; Zhu, Lihua J.; Yen, Kelvin; Tissenbaum, Heidi A. (20 Ocak 2015). "Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants". Proceedings of the National Academy of Sciences (İngilizce). 112 (3): E277-86. Bibcode:2015PNAS..112E.277B. doi:10.1073/pnas.1412192112. ISSN 0027-8424. PMC 4311797 $2. PMID 25561524.
- ^ Turner BS (2009). Can We Live Forever? A Sociological and Moral Inquiry. Anthem Press. s. 3.
- ^ "agerasia." Oxford Dictionary of English 2e, Oxford University Press, 2003.
- ^ a b Japsen B (15 Haziran 2009). "AMA report questions science behind using hormones as anti-aging treatment". The Chicago Tribune. 8 Aralık 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Temmuz 2009.
- ^ Holliday R (April 2009). "The extreme arrogance of anti-aging medicine". Biogerontology. 10 (2): 223-228. doi:10.1007/s10522-008-9170-6. PMID 18726707.
- ^ Olshansky SJ, Hayflick L, Carnes BA (August 2002). "Position statement on human aging". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 57 (8): B292-B297. doi:10.1093/gerona/57.8.B292. PMID 12145354.
- ^ Warner H, Anderson J, Austad S, Bergamini E, Bredesen D, Butler R, Carnes BA, Clark BF, Cristofalo V, Faulkner J, Guarente L, Harrison DE, Kirkwood T, Lithgow G, Martin G, Masoro E, Melov S, Miller RA, Olshansky SJ, Partridge L, Pereira-Smith O, Perls T, Richardson A, Smith J, von Zglinicki T, Wang E, Wei JY, Williams TF (November 2005). "Science fact and the SENS agenda. What can we reasonably expect from ageing research?". EMBO Reports. 6 (11): 1006-1008. doi:10.1038/sj.embor.7400555. PMC 1371037 $2. PMID 16264422.