
Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.

Mıknatıs ya da demirkapan, manyetik alan üreten nesne veya malzemedir. Demir, nikel, kobalt gibi bazı metalleri çeker, bakır ve alüminyum gibi bazı metallere ve metal olmayan malzemelere etki etmez.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.
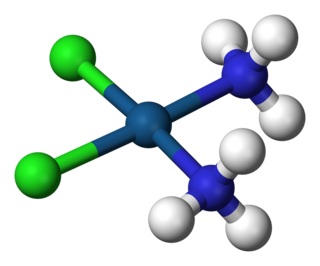
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.
Ligand ya da ligant, merkezî bir metale bağlanan bir atom, iyon veya moleküldür. Bu bağ genelde bir veya birkaç elektron verilmesiyle oluşur, kovalent de olabilir iyonik de. Ayrıca, metal-ligand bağ değeri birden üçe kadar uzanabilir. Ligandlar genelde Lewis bazı(en) olarak sayılırlar ama ender olarak Lewis asidi ligandlar da olabilir.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.
Hesaplamalı kimya, kimya problemlerini çözmeye yardımcı olmak için bilgisayar simülasyonunu kullanan bir kimya dalıdır. Moleküllerin, katıların yapı ve özelliklerini hesaplamak için verimli bilgisayar programlarına dahil edilmiş teorik kimya yöntemlerini kullanır. Bu yöntemlerin kullanılmasının nedeni, hidrojen moleküler iyonu ile ilgili nispeten yeni sonuçlar dışında, kuantum çok-gövdeli(many-body) problemlerin analitik olarak çözülemez oluşudur. Hesaplama sonuçları normal olarak kimyasal deneylerle elde edilen bilgileri tamamlarken, bazı durumlarda gözlemlenmeyen kimyasal olayları da tahmin edebilmektedir. Yeni ilaç ve materyallerin tasarımında yaygın olarak kullanılmaktadır.

Kimyada, HOMO ve LUMO moleküler orbital tipleridir. Kısatlamarın açılımları sırası ile "highest occupied molecular orbital-en yüksek dolu moleküler orbital" ve "lowest unoccupied molecular orbital-en düşük dolu olmayan moleküler orbitaldir".

Yöresizleşmiş elektronlar veya delokalize elektronlar bir katı metal, iyon veya molekülde bulunan elektronların tek bir atom veya kovalent bağ ile ilişkili olmamasını tanımlar.
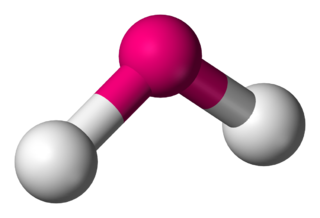
Kimyada, " açısal" ya da "bükülmüş" terimi bazı moleküllere moleküler geometrilerini tanımlamak için kullanılabilir. Oksijen gibi bazı atomlar, Elektron dizilimi nedeniyle hemen hemen her zaman iki (veya daha fazla) kovalent bağını doğrusal olmayan yönlerde ayarlarlar. Su (H2O), analoglarının yanı sıra açısal bir molekül örneğidir. İki hidrojen atomu arasındaki bağ açısı yaklaşık olarak 104,45°'dir. Doğrusal olmayan geometri genel olarak sadece ana grup elementleri içeren diğer üç atomlu molekülleri ve iyonlar için gözlemlenir, belirgin örnekler: Azot dioksit (NO2), kükürt diklorür (SCL2) ve metilen (CH2).
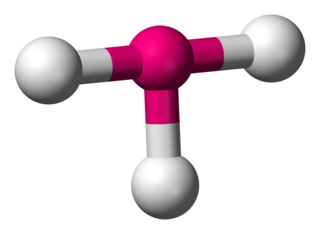
Kimyada, T-şeklindeki moleküler geometri, merkezi bir atomun üç liganda sahip olduğu bazı moleküllerin yapılarını açıklar. Normalde, üç koordineli bileşikler üçgen düzlemsel veya piramidal geometrileri kullanır. T-şekilli moleküllerin örnekleri arasında, halojen triflorürler vardır, örneğin ClF3.
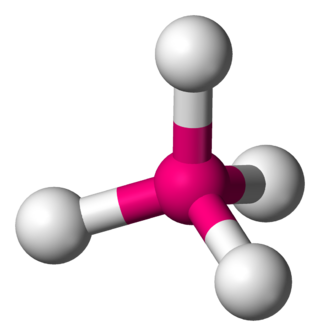
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Kimyada, çift kepli üçgen prizmatik moleküler geometri, sekiz atom, atom grupları veya ligand gruplarının, çift-taraflı bir üçgen prizmanın köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini açıklar. Bu şekil, C2v olan simetri ile birlikte, okta-koordine geçiş metali kompleksleri için kare antiprizma ve onikiyüzlü ile birlikte üç genel biçimlerinden bir tanesidir.

Kimyada, onikiyüzlü moleküler geometri, sekiz atomun, atom gruplarının veya ligandların bir snub disfenojeninin köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini tarif eder. Bu şekil D2d simetriye sahiptir ve kare antiprizma ve çift kepli üçgen prizma ile birlikte oktakoordinat geçiş metali kompleksleri için üç ortak şekilden biridir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.

















