Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Sabun, uzun zincirli organik yağ asitlerinin Na veya K tuzlarıdır.

Lipit, tüm canlıların yapısında bulunan temel organik bileşiklerden biridir. Lipitler, doymuş ve doymamış yağlar olarak ayrılır. Doymamış yağlar, oda sıcaklığında sıvı hâlde bulunan lipitler; doymuş yağlar ise oda sıcaklığında katı hâlde bulunan lipitlerdir. Biyolojik önemi olan lipitler için yağ asitleri, nötr lipitler (trigliserit), fosfolipitler ve steroitler örnek gösterilebilir. Lipitler, insan ve hayvanların temel besinleri arasında yer alır.

Alkol, karbon atomuna doğrudan bir -OH (hidroksil) grubunun bağlı olduğu organik bileşiklere verilen genel ad. Genel formülü CnH2n+1OH olan mono alkoller, alkollerin önemli bir sınıfıdır. Bunlardan etanol (C2H5OH), alkollü içeceklerde bulunan türüdür. Genellikle alkol kelimesi ile etanol kastedilir ki yeni fermente olmuş birada etanol oranı %3-5 arasında iken şarapta %12-15 arasındadır.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

Fosfolipitler dört bileşenden oluşurlar; bir veya iki yağ asit grubu, negatif yüklü bir fosfat grubu, bir alkol grubu ve de bunları birbirine bağlayan bir omurga. Gliserol omurgalı fosfolipitlere gliserofosfolipit veya fosfogliserit denir. Sfingozin omurgalı tek bir fosfolipit vardır: sfingomiyelin. Hücre zarlarının (membranlarının) ana bileşenleri fosfolipitler, kolesterol ve glikolipitlerdir.
Kimya ve biyokimyada, yağ asidi, genelde uzun, alifatik kuyruklu bir karboksilik asittir. Uzun karboksilik yağ asitlerinden 4 karbonlu ve daha uzun zincirlileri yağ asidi olarak sayılır; doğal yağları (trigliseritleri) oluşturan yağ asitlerinden söz ederken ise bunların en az 8 karbonlu olduğu varsayılabilir. Çoğu doğal yağ asitlerinin çift sayılı karbon atomu vardır, çünkü bunların biyolojik sentezlerinde iki karbon atomlu asetat kullanılır.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).
Esterleşme, esterler genel olarak karbon asitlerinden elde edilmektedirler. Burada karbon asitlerinde bulunan –OH grubu (alkol) bir –OR grubuyla yer değiştirmesi sonucunda oluşmaktadır. Esterleşme tepkimelerin gerçekleşmesi için ısının yanı sıra katalizör olarak da genellikle Sülfürik asit ve hidroklorik asit kullanılmaktadır. Aşağıdaki tabloda asit katalizörle tepkimesini gösteren bir şema görebiliriz.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

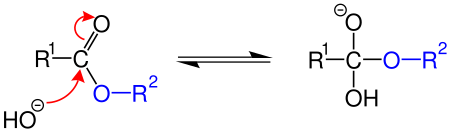
Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Eterler, iki organik kısmın bir oksijen atomu üzerinden birbirine bağ yapmış organik moleküllerdir. Eterlerin genel formülü R-O-R' şeklindedir. Buradaki R ve R' aynı olabileceği gibi farklı organik kısımlar da olabilirler.

Sülfat iyonu, inorganik kimyada bir sülfür atomu ile bunu tetrahedral yapıda çevreleyen dört eş oksijen atomundan oluşan, negatif yüklü bir anyondur. Ampirik formülü SO42- ve moleküler ağırlığı 96,06 daltondur. Hidrojenle birleştiğinde sülfürik asit oluşturur. Ayrıca,Dimetil sülfat gibi organik sülfatlar, kovalent bileşiklerdir ve sülfürik asidin esterleridir.
- Sülfürik asitte metalin eritilmesi
- Sülfürik asidin bir metal hidroksit veya oksit ile reaksiyonu
- Metal sülfür veya sülfitlerin oksidasyonu
HCl veya HBr gibi halohidrik asitlerin alkenlere katılımıyla haloalkanlar meydana gelir. Alkenlerde hidrojen ve Halojenlerin katılmalarında iki farklı durum ortaya çıkar. Eğer katılmaya giren alken eten gibi sadece birincil karbonlardan oluşan bir alken ise tepkime yandaki gibi sonuçlanır.
Nükleofil ismi, atomun artı kısmı manasına gelen nucleo ve Yunancada seven manasına gelen philos kelimelerinden oluşmaktadır. İsimden de anlaşılacağı gibi nükleofiller artı parçacıkları seven artı merkez arayışı içinde olan moleküllerdir. Bu tür tepkimelerde nükleofiller yani bir çift ortaklaşmamış elektrona sahip molekül, bir alkil halojenürün halojen kısmıyla yer değiştrir işte bu şekilde gerçekleşen yer değişikliklerine Nükleofil yer değiştirme tepkimeleri denir. Elektronegatif halojen elektronları kendine doğru çektiğinden dolayı Karbon otomu üzerinde kısmi bir pozitif yük oluşmuş oluyor. Bu tepkimede de görüldüğü gibi bir yer değiştirme işlemi vardır.
Alkin halojenürlerin katıldıkları bir başka tepkime çeşidiyse ayrılma tepkimeleridir. Bu tepkime esnasında molekülün yapısında bulunan XY gibi bir molekül alkil halojenürlerin yapısından ayrılır bunun sonucunda da çoklu bağlar oluşmaktadır.
Alkali hidrolizi, organik kimyada, görev alan nükleofilin hidroksit iyonu olduğu nükleofilik yerdeğiştirme reaksiyon türü.