
Helyum, sembolü He ve atom numarası 2 olan kimyasal element. Periyodik cetvelin birinci periyot 8A grubunda yer alan bir gazdır. Kokusuz, renksiz bir gazdır ve yanmaz.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.
Ametal, metal özelliği göstermeyen elementlerdir. Isıyı ve elektrik akımını iletmek gibi metallere özgü özellikleri göstermezler. Ayrıca kendi aralarındaki ortak özellikleri yok denecek kadar azdır. Genellikle karbon, azot, fosfor, oksijen, kükürt, selenyum, flor, klor, brom, iyot ve soy gaz elementlerine ametal denir.

Oksijen atom numarası 8 olan ve O harfi ile simgelenen kimyasal elementtir. Oksijen ismi Yunanca ὀξύς (oxis - "asit", tam anlamıyla "keskin", asitlerin acı tadı kastedilir) ve -γενής (-genēs) ("üretici", tam anlamıyla "sebep olan şey") köklerinden gelmektedir, çünkü isimlendirildiği zamanlarda tüm asitlerin oksijen içerikli olduğu sanılırdı. Standart şartlar altında, elementin iki atomu bağlanarak çok soluk mavi renkte, kokusuz, tatsız, diatomik yapıdaki, O2 formülüne sahip dioksijen gazını oluşturur.
Celsius ölçeği, 1742'de İsveçli astronom Anders Celsius'un ismiyle adlandırılmış bir sıcaklık ölçme birimidir.

Hâl değişimi, bir maddenin moleküller arası potansiyel enerjisinin ısı alarak ya da vererek değişmesi sonucu meydana gelen olay.

Kriyojeni, fizikte çok düşük sıcaklıklarda yapılan üretim ve işlemler için kullanılan terimdir.Kriyojenist ise bu düşük sıcaklıklarda bu işlemleri yapan kişiye denir. Kriyojenist Celcius ve Fahrenheit'ın yerine mutlak değerler içeren Kelvin ve rankin skalalarını baz alır. Kriyojeni terimi çoğu zaman kurgu veya popüler kültürde yanlış olarak kullanılır. Bu bilim dalı birkaç terim içerir. Örneğin kriyobiyoloji, düşük sıcaklıkların organizmalara etkisini inceleyen bir biyoloji dalıdır. Kriyoameliyat, -196 santigrat dereceye kadar düşük sıcaklıklarda yapılan kanser hücreleri yok etme ameliyatlarına denir. Kriyoni, insan ve hayvan parçalarını gelecekte tekrar canlandırabilecek olan kriyomuhafazanın gelişmekte olan tıbbi teknoloji dalıdır. Sahadaki araştırmacılar kriyobiyoloji, kriyojeni, akışbilimi'nin de içinde bulunduğu birçok bilimin sonuçlarını uygulamaya koymaya çalışıyorlar. Kriyoelektronik, düşük sıcaklıklardaki süperiletkenliği inceleyen bilim dalıdır. Kriyotronik, kriyoelektroniğin pratik uygulamasıdır. Kriyoetik, kriyoniklerin etiksel içeriklerini inceleyen daldır. Kimin vücudunu dondurup öldürücü koşullardan kurtulmak ve gelecekte tedavi edilebilip önlenebilecek şeyler için vücudunu dondurmak istediğine odaklanır.

Kaynama noktası, sıvının buhar basıncının dış basınca eşit olduğu andaki sıcaklığıdır. Buhar basıncı yüksek olan sıvılar uçucudur ve kaynama noktaları düşüktür. Vakum işlemiyle buhar basıncı arttırılarak, kaynama noktası yüksek olan sıvılar oda sıcaklığında kaynatılabilir.
- Kaynama noktasına göre elementler
- Kaynama noktasına göre bazı çözücüler

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.

Buharlaşma ısısı veya diğer adıyla buharlaşma entalpisi, birim miktardaki bir sıvının gaz haline dönüşmesi için gereken enerjidir. Sıvının kaynama sıcaklığında ölçülür ve genellikle joule/gram veya kJ/mol birimleri cinsinden ifade edilir. Daha genel kullanımı molar buharlaşma entalpisi olup anlamı bir mol sıvıyı buharlaştırmak için gereken enerji toplamıdır.

Damıtma ya da destilasyon, iki veya daha fazla bileşen içeren bir karışımın ısıtılıp, buhar ve sıvı faz oluşturmak suretiyle daha uçucu bileşence zengin karışımların elde edilmesini sağlayan ayırma işlemidir. Ayırma işlemi sırasında, buhar faz daha uçucu olan A bileşeni tarafından zenginleşirken, sıvı faz ise kaynama sıcaklığı daha yüksek olan B bileşenince zenginleşir. Fakat yüzde 100 A içeren bir buhar faz elde edilemez.

Sıcaklıkölçer ya da Termometre, sıcaklığı ölçmek için kullanılan alet.
Kaynama, sıvının buhar basıncının dış basınca eşit olduğunda, sıvının her yerinden gaz kabarcıklarının çıkması. Saf maddelerin sabit atmosfer basıncı altında kaynama noktası sabittir. Kaynama süresi boyunca maddenin sıcaklığı değişmez. Sıvı bir maddenin içine uçucu olmayan bir çözünen eklenirse çözeltinin kaynama noktası yükselir. Çözünen madde miktarı arttıkça kaynama noktası yükselecektir. Aynı ortamdaki bütün sıvıların kaynama anındaki buhar basınçları eşittir, ancak maddelerin kaynama sıcaklığı maddenin cinsine, saflığına ve ortamın dış basıncına bağlıdır. Kaynama sıcaklığı maddeler için ayırt edici bir özelliktir.

Haşlama ya da kaynatma, yiyeceklerin su veya su oranı yüksek bir sıvı içinde kaynama noktasına yakın bir sıcaklıkta pişirilmesi yöntemidir.
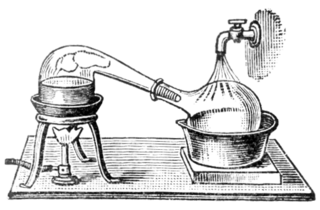
Ayrımsal damıtma, kaynama noktaları birbirinden farklı sıvıların karışımlarına uygulanan damıtma işlemidir. Sıvı+sıvı çözeltiler için kullanır. Çözelti damıtma kabında ısıtılınca, kaynama noktası düşük olan sıvı kaynayarak karışımdan ayrılır. Tekrar sıvılaştırılarak başka bir kap içinde biriktirilir ve böylece ayrım işlemi tamamlanmış olur. Erken kaynayarak ayrışan sıvının soğutularak yeniden yoğuşturulması için genellikle su kullanılır.

Kimyasal madde, kimyevî madde veya kısaca kimyasal, sabit bir kimyasal bileşimi ve karakteristik özelliklere sahip bir madde türüdür. Bu kimyasal bağlar bozulmadan, fiziksel ayırma yöntemleri ile bileşenlerine ayrılmaz. Bu kimyasallar katı, sıvı veya gaz hâlinde olurlar.

Süperakışkanlık maddenin sıfır akmazlığa sahip bir akışkan gibi davrandığı hâlidir. Bu fenomen ilk olarak sıvı helyum ile keşfedildiyse de yalnızca sıvı helyum teorisinde değil aynı zamanda astrofizik, yüksek enerji fiziği ve kuantum kütleçekimi teorilerinde de uygulama alanına girmiştir. Bu fenomen Bose-Einstein yoğunlaşması ile bağıntılıdır ancak özdeş değildir: Bütün Bose-Einstein yoğuşukları süperakışkan olmadığı gibi bütün süperakışkanlar da Bose-Einstein yoğuşuğu değildir.

Buharlaşma, bir sıvının gaz fazına geçerken yüzeyinde oluşan buharlaşma türüdür. Çevreleyen gazdaki buharlaşan maddenin yüksek konsantrasyonu, örneğin çevredeki nemin suyun buharlaşma hızını etkilemesiyle buharlaşma yavaşlar.
İzopentan (C5H12),metilbütan ya da 2-metilbütan, beş karbon atomuna sahip bir dallanmış zincirli alkandır. İzopentan, oda sıcaklığında ve basıncında aşırı uçucu ve aşırı yanıcı bir sıvıdır. Aynı zamanda standart sıcaklık ve basınçta en az yoğun olan sıvıdır. Normal kaynama noktası oda sıcaklığından sadece birkaç derece yüksektir ve izopentan sıcak bir günde kolayca kaynamakta ve buharlaşmaktadır. İzopentan yaygın olarak sıvı azot ile birlikte -160 °C sıvı banyo sıcaklığına ulaşmak için kullanılır. Doğal gaz tipik olarak %1 veya daha az izopentan içerir.

Leidenfrost etkisi, 1756 yılında Alman bilim adamı Johann Gottlob Leidenfrost tarafından keşfedilen ve A Tract About Some Qualities of Common Water kitabında konu edindiği, sıvıların yüzeyleri ile temas ettiklerinde oluşan ve sıvının hızlı buharlaşması sonucu yüzeyde bir buhar tabakası oluşmasına neden olan fiziksel bir fenomendir. Bu buhar tabakası, sıvının yüzeyinde oluşan bir yalıtkan tabaka görevi görür ve bu sayede sıvının yüzeyine dokunulduğunda, sıvı damlacıklarının hoplayarak hareket etmesine ve hatta bazen buharlaşarak tamamen kaybolmasına neden olur. Bu etki, sıvıların yüzeylerindeki buharlaşma hızı ile sıvının sıcaklığı, yüzey gerilimi ve çevresel koşullar gibi faktörlerden etkilenir.














