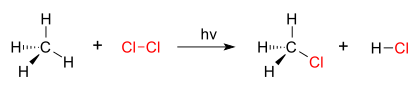
Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.
Organik kimyada bir sübstitüent, bir hidrokarbon zincirindeki hidrojen atomlarından birinin yerini almış bir atom veya atomlar grubudur. Bir sübstitüente sahip olan bir organik bileşikler isimlendirilirken -il soneki kullanılır. Sübstitüenti olan bir hidrokarbon adlandırılırken, sübstitüentin bağlı olduğu karbon atomunun yer numarası da belirtilir, eğer bu bilgi yapısal izomerleri ayırt etmek için gerekliyse. Bir sübstitüentin polar etkisi endüktif etki ile mezomerik etkinin bileşimidir. Sübstitüentin işgal ettiği hacim sterik etkilere de yol açar.

Organik kimyada fonksiyonel grup, içinde bulundukları moleküllerin karakteristik kimyasal tepkimelerinden sorumlu belli atom gruplarıdır. Aynı fonksiyonel grup aynı veya benzer kimyasal tepkimere girer, ait olduğu molekülün büyüklüğünden bağımsız olarak.

Kimyada istiflenme, genelde aromatik olan moleküllerin atomlar arası etkileşerek deste şeklinde üst üst üste gelmesidir. İstiflenmiş bir sistemin en yaygın bilinen örneği DNA molekülünde birbirini takibeden bazlarda görülür. İstiflenme proteinlerde, non-polar iki halkanın örtüşmesi halinde de meydana gelir. Hangi moleküllerarası kuvvetlerin istiflenmeye neden olduğu hâlen tartışma konusudur.

Kimyada radikaller eşleşmemiş elektronu olan atom, molekül veya iyonlardır. Bu eşleşmemiş elektronlar genelde son derece reaktiftir. Radikaller, yanma, atmosfer kimyası, polimerleşme, plazma kimyası, biyokimya ve pek çok başka kimyasal süreçte önemli rol oynar. Örneğin, insan fizyolojisinde, süperoksit ve azot oksit, damar tonusu gibi pek çok biyolojik süreci düzenler. Radikal ve serbest radikal terimleri genelde eşanlamlı kullanılmakla beraber, bir radikal bir çözelti kafesi içinde hapsolmuş veya başka bir moleküle bağlanmış durumda olabilir. 1900'de Michigan Üniversitesi'nde Moses Gomberg tarafından betimlenen trifenilmetil radikali, ilk tespit edilmiş organik serbest radikal olmuştur.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.

Kimyada, bölgesel seçicilik, kimyasal bağlanma ya da kırma sırasında bir yönün, diğer tüm yönlere tercih edilmesidir. Hangi protonun hangi olası pozisyonlardan hangisini etkileyeceği, örneğin hangi protonun güçlü bir bazın bir organik molekülden soyutlanacağı veya ikame edilmiş bir benzen halkası üzerinde başka bir ikame edicinin ekleneceği gibi birden fazla pozisyonun etkileneceği durumlarda uygulanır.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.

Nitro bileşikleri, bir veya daha fazla nitro fonksiyonel grubu (−NO2) içeren organik bileşiklerdir. Nitro grubu, dünya çapında kullanılan en yaygın eksplosoforlardan (bileşiği patlayıcı madde yapan fonksiyonel grup) biridir. Nitro grubuda güçlü bir elektron çeken gruptur. Bu özellik nedeniyle, nitro grubuna alfa (bitişik) olan C-H bağları asidik olabilir. Aynı nedenden dolayı, aromatik bileşiklerde nitro grubunun varlığı elektrofilik aromatik sübstitüsyonu yavaşlatsa da nükleofilik aromatik sübstitüsyonu kolaylaştırır. Nitro grupları, doğada nadiren bulunur ve nitrik asit ile başlayan nitrolama reaksiyonları tarafından neredeyse her zaman üretilir.

Bir Grignard reaktifi veya Grignard bileşiği, X'in bir halojen ve R'nin normalde bir alkil veya aril olduğu organik bir grup olduğu genel formül R−Mg−X'e sahip kimyasal bir bileşiktir. İki tipik örnek, metilmagnezyum klorür Cl−Mg−CH
3 ve fenilmagnezyum bromür (C
6H
5)−Mg−Br'dir. Organomagnezyum bileşiklerinin bir alt sınıfıdır.
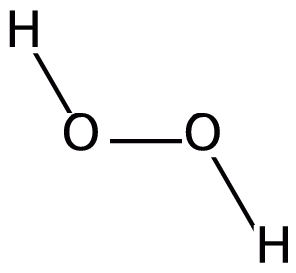
Fenton reaktifi kirleticileri veya atık suları oksitlemede kullanılan, katalizör olarak demir içeren bir demir bileşiği (genellikle demir (II) sülfat, FeSO4) ile hidrojen peroksitin (H2O2) bir çözeltisidir. Fenton reaktifi, trikloroetilen (TCE) ve tetrakloroetilen (perkloroetilen, PCE) gibi organik bileşikleri yok etmek için kullanılabilir. 1890'larda Henry John Horstman Fenton tarafından analitik bir reaktif olarak geliştirilmiştir.
Elektrofilik aromatik sübstitüsyon, bir aromatik sisteme bağlı bir atomun bir elektrofil ile değiştirildiği organik reaksiyondur. En önemli elektrofilik aromatik sübstitüsyonlardan bazıları aromatik nitrolama, aromatik halojenasyon, aromatik sülfonasyon, alkilasyon ve açilasyon tipindeki Friedel– Crafts reaksiyonudur.
Halometan bileşikleri, bir veya daha fazla hidrojen atomunun halojen atomları (flor, klor, brom veya iyot) ile değiştirildiği metan (CH4) türevleridir. Halometanlar hem özellikle deniz ortamlarında doğal olarak bulunurlar hem de özellikle soğutucu akışkanlar, çözücüler, itici gazlar ve fumigantlar olarak insan yapımıdır. Kloroflorokarbonlar da dâhil olmak üzere birçoğu, yüksek rakımlarda bulunan ultraviyole ışığa maruz kaldıklarında aktif hâle geldikleri ve Dünya'nın koruyucu ozon tabakasını incelttikleri için geniş ilgi gördü.
Serbest radikal reaksiyonu, serbest radikal içeren herhangi bir kimyasal reaksiyondur. Bu reaksiyon türü organik reaksiyonlardasıkça geçer. Serbest radikal reaksiyonlarına ilişkin iki öncü çalışma, Moses Gomberg (1900) tarafından trifenilmetil radikalinin keşfi ve 1927'de Friedrich Paneth tarafından açıklanan kurşun ayna deneyi olmuştur. Bu son deneyde tetrametilkurşun, yüksek sıcaklıklarda bir kuvars tüp içinde metil radikallerine ve elementel kurşuna ayrışır. Gaz hâldeki metil radikalleri, bir taşıyıcı gaz içinde odanın başka bir kısmına taşınır ve burada yavaş yavaş kaybolan bir ayna filmi içinde kurşunla reaksiyona girer.