
Proteinler, bir veya daha fazla uzun amino asit artık zincirini içeren büyük biyomoleküller ve makromolekül'lerdir. Proteinler organizmalar içinde, hücrelere yapı ve organizmalar sağlayarak ve molekülleri bir konumdan diğerine taşıyarak metabolik reaksiyonları katalizleme, DNA kopyalama, uyaranlara yanıt verme dahil olmak üzere çok çeşitli işlevler gerçekleştirir. Proteinler, genlerinin nükleotit dizisi tarafından dikte edilen ve genellikle faaliyetini belirleyen özel 3D yapıya protein katlanmasıyla sonuçlanan amino asit dizilimlerinde birbirlerinden farklıdır.

Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.
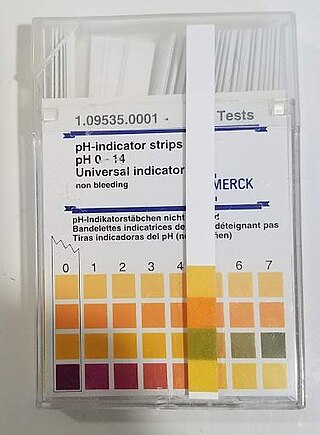
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.
Enzimler, kataliz yapan biyomoleküllerdir. Neredeyse tüm enzimler protein yapılıdır. Enzim tepkimelerinde, bu sürece giren moleküllere substrat denir ve enzim bunları farklı moleküllere, ürünlere dönüştürür. Bir canlı hücredeki tepkimelerin neredeyse tamamı yeterince hızlı olabilmek için enzimlere gerek duyar. Enzimler substratları için son derece seçici oldukları için ve pek çok olası tepkimeden sadece birkaçını hızlandırdıklarından dolayı, bir hücredeki enzimlerin kümesi o hücrede hangi metabolik yolakların bulunduğunu belirler.

Glisin (kısaltılmışı Gly ya da G) formülü NH2CH2COOH olan apolar bir aminoasittir. Glisin kodonları GGU, GGC, GGA, GGG cf. genetik koddur. Yapısal olarak proteinlerde bulunan 20 aminoasit arasında en basit olanıdır. Yan zinciri sadece bir hidrojen atomundan ibarettir. Glisindeki α-karbon atomu da bir hidrojene bağlı olduğu için, glisin optik olarak aktif değildir, diğer bir deyişle optik izomeri bulunmamaktadır.
Histidin doğada yaygın 22 aminoasitten biridir ve proteinlerin yapısında bulunur. L-Histidin ve D-Histidin olmak üzere iki farklı enantiomerik formu vardır. Beslenme açısından, genelde sadece çocuklarda, dışarıdan alınması zaruri gıda maddelerinden biridir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Potasyum hidrojen ftalat, genellikle basitçe KHP, beyaz veya renksiz, fatlik asidin monopotasyum tuzu olan iyonik bir katı maddedir. Hidrojen hafifçe asidiktir ve katı ve havaya dirençli olduğu için; en doğru şekilde tartılmayı sağladığından, asit-baz eşdeğerleyimlerinde temel ölçün/standart olarak sıklıkla kullanılmaktadır. Ancak hafifçe higroskopiktir ve kullanımdan önce genellikle bir kurutucu (biyokimya) içinde saklanır. Yukarıda anlatılan özelliklerinin yanı sıra çözelti içinde pH'ı çok dengeli olduğu için aynı zamanda pH metreleri ayarlamada temel bir ölçün/standart olarak kullanılmaktadır. Aşağıdaki tabloda farklı sıcaklık derecelerinde KHP'nin 0.05 mol kg−1lik sulu/aköz çözeltisinin pH değerleri verilmiştir:
Hidronyum (H3O) ;IUPAC'te adlandırılması oksonyum şeklindedir. Bir molekülünde 3 hidrojen ve 1 oksijen atomu bulunur. Hidronyum iyonu, (H3O) asitler suda çözündüklerinde açığa çıkan katyondur. Aynı zamanda asitleri bazlardan ayırmada kullanılır. (Brønsted-Lowry asit-baz teorisi)Bir asit suda çözündüğü zaman hidronyum katyonu ortaya çıkar. Bazı asit çözünme tepkimelerinde kolaylık olması amacıyla (H+) iyonu şeklinde de gösterilse de doğru kullanımı (H3O) şeklindedir. pH'ın belirlemesinde kullanılır. Eğer çözünen maddenin [H+] konsantrasyonu ile [OH-] eşitse o madde nötrdür.
Protein saflaştırması, karmaşık bir karışımdan tek bir tip proteini izole etmek için izlenen bir seri süreçtir. İlgi duyulan bir proteinin işlevi, yapısı ve diğer proteinlerle etkileşiminin karakterizasyonu için protein saflaştırması şarttır. Başlangıç malzemesi genelde bir biyolojik doku veya mikrobiyal kültürdür. Saflaştırma sürecinin çeşitli adımları sonucunda, protein içinde hapsolduğu ortamdan kurtarılır, karışımda bulunan protein olan ve protein olmayan kısımlar birbirinden ayrılır ve nihayet arzulanan protein tüm diğer proteinlerden ayrıştırılır. Bir proteinin diğer tüm proteinlerden ayrıştırmak, protein saflaştırmasının en zahmetli yanıdır. Ayrıştırma adımlarında proteinlerdeki büyüklük, fizikokimyasal özellikler, bağlanma afinitesi ve biyolojik etkinlik gibi unsurlardaki farklılıklardan yararlanılır.
Asit-baz homeostazı insan homeostazının asitler ve bazlar arasındaki denge (pH) ile ilgilenen dalıdır. İnsan dokuları küçük pH değişikliklerine oldukça hassastır; bu nedenle pH'ı düzenleyen güçlü mekanizmalar vardır. Uygun pH aralığının dışındaki pH değerlerinde proteinler denatüre olur, enzimlerin çalışması durur ve kişi hayatını kaybedebilir.
Tampon çözelti zayıf asit ve konjuge bazın veya zayıf baz ve konjuge asitin karşımından oluşan sulu çözelti. Tampon çözeltiye küçük veya orta miktarda güçlü asit veya baz eklendiğinde pH değişimi çok az olur ve bu nedenle çözeltilerde pH değişimini engellemek için kullanılır. Çoğu canlı formu sadece küçük bir pH aralığında gelişir, bundan dolayı sabit pH'ı sürdürmek için tampon çözeltiyi kullanırlar. Doğada, bikarbonat tampon sistemi kandaki pH'ı düzenlemek için kullanılır.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Kimyada, bir tuz köprüsü iki kovalent olmayan etkileşimin bir kombinasyonudur. İyon eşleştirme, kimyada, biyolojik sistemlerde, farklı materyallerde ve iyon çifti kromatografisi gibi birçok uygulamada en önemli kovalent olmayan kuvvetlerden biridir. Proteinlerin entropik olarak elverişsiz katlanmış konformasyonuna kararlılık sağlayan en yaygın faktördür. Kovalent olmayan etkileşimlerin nispeten zayıf etkileşimler olduğu bilinmesine rağmen, küçük stabilize edici etkileşimler bir araya geldiğinde konformer kararlılığına büyük derece bir atkı gerçekleştirebilirler. Sadece proteinlerde değil, tuz köprüleri aynı zamanda supramoleküler kimyada da bulunabilirler.

pH ölçer veya pH metre, su esaslı çözeltilerdeki hidrojen iyonu aktivitesini ölçen, asitliğini veya pH olarak ifade edilen bazikliğini gösteren bilimsel bir cihazdır. PH ölçer bir pH elektroduyla referans bir elektrot arasındaki elektrik potansiyeli farkını ölçer ve bu nedenle pH ölçer bazen "potansiyometrik pH ölçer" olarak adlandırılır. Elektrik potansiyelindeki fark çözeltinin asitliği veya pH'ı ile ilgilidir. PH ölçer, laboratuvar deneylerinden kalite kontrolüne kadar birçok uygulamada kullanılır.
Çözülme, çözücünün moleküller ile etkileşimini tanımlar. Hem iyonize hem de yüksüz moleküller, çözücü ile güçlü bir şekilde etkileşir ve bu etkileşimin gücü ve doğası, çözücünün viskozite ve yoğunluk gibi özelliklerini etkilemenin yanı sıra çözünürlük, reaktivite ve renk dahil olmak üzere çözülen maddenin birçok özelliğini etkiler. Çözülme sürecinde iyonlar eş merkezli bir çözücü kabuğu ile çevrelenir. Çözülme, çözücü ve çözünen moleküllerin çözünme kompleksleri halinde yeniden düzenlenmesi sürecidir.

Johan Gustav Christoffer Thorsager Kjeldahl, kendisinden sonra Kjeldahl yöntemi olarak adlandırılan bir laboratuvar tekniği kullanarak belirli organik bileşiklerdeki nitrojen miktarını belirlemek için bir yöntem geliştiren Danimarkalı bir kimyagerdir.













