Alkali metaller periyodik tablonun birinci grubunda yer alan metallerdir. Fransiyum dışında hepsi, yumuşak yapıda ve parlak görünümdedir.

Fisyon, kütle numarası çok büyük bir atom çekirdeğinin parçalanarak kütle numarası küçük iki veya daha fazla çekirdeğe dönüşmesi olayıdır. Fisyon reaksiyonlarında radyoaktif elementler kullanılır ve tepkimeler için bir ilk enerjiye ihtiyaç vardır. Reaksiyon sonucunda kararsız çekirdekler ve nötron oluşur. Oluşan nötronların her biri yeni bir uranyum atomu ile tepkimeye girer. Bu esnada açığa çıkan nötronlar ortamdan uzaklaştırılmazsa tepkime zincirleme olarak devam eder.

Fotosentez, bitkiler ve diğer canlılar tarafından, ışık enerjisini organizmaların yaşamsal eylemlerine enerji sağlamak için daha sonra serbest bırakılabilecek kimyasal enerjiye dönüştürmek için kullanılan bir işlemdir. Bu kimyasal enerji, karbondioksit ve sudan sentezlenen şekerler gibi karbonhidrat moleküllerinde depolanır.
Kimyasal denge, iki yönlü bir tepkimede ürünlerin meydana geliş hızının, ürünlerden tekrar tepkimeye girenlerin meydana geliş hızına eşit olduğu durumdur. Böyle denklemlerde tepkimenin her iki tarafa olabileceğini göstermek için çift yönlü ok  kullanılır. Genel olarak şöyle göstermek mümkündür:
kullanılır. Genel olarak şöyle göstermek mümkündür:


Kimyasal tepkime ya da kimyasal reaksiyon, iki veya daha fazla maddenin birbiri ile etkileşmesi sonucu kendi özelliklerini kaybederek yeni özellikte maddeler oluşturmasıdır. Kimyasal olay ve kimyasal değişme kavramlarıyla eşanlamlıdır. Kimyasal reaksiyonların test edilmesi için Periyodik tablo metalleri ile aside koyarak yapılabilir.

Radyoaktif elementlerin kararlı bir element oluşturması işlemi sırasında bunlar birkaç sayıda farklı reaksiyona (tepkimeye) uğrayabilirler. Nükleer fisyon (bölünme) böyle bir reaksiyondur. Atom sayısı 90 'dan büyük olan elementler fisyona uğrayabilirler.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.
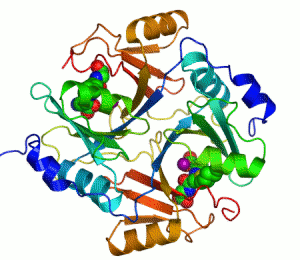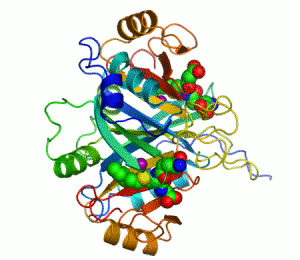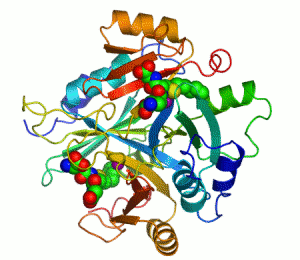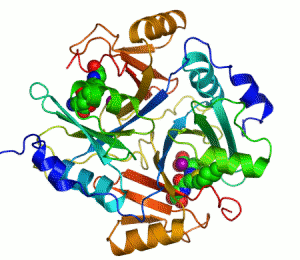
Enzimler, kataliz yapan biyomoleküllerdir. Neredeyse tüm enzimler protein yapılıdır. Enzim tepkimelerinde, bu sürece giren moleküllere substrat denir ve enzim bunları farklı moleküllere, ürünlere dönüştürür. Bir canlı hücredeki tepkimelerin neredeyse tamamı yeterince hızlı olabilmek için enzimlere gerek duyar. Enzimler substratları için son derece seçici oldukları için ve pek çok olası tepkimeden sadece birkaçını hızlandırdıklarından dolayı, bir hücredeki enzimlerin kümesi o hücrede hangi metabolik yolakların bulunduğunu belirler.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Krebs döngüsü, trikarboksilik asit döngüsü veya sitrik asit döngüsü, canlı hücrelerin besinleri yükseltgeyerek enerji elde etmesini sağlayan ve bütün yaşam biçimlerinde önemli bir yer tutan kimyasal süreçlerin son aşamasıdır. TCA devri olarak da bilinir. 1937'de Hans Adolf Krebs tarafından açıklığa kavuşturulan tepkimelerin hayvan, bitki, mikroorganizma ve mantar gibi birçok hücre türünde oluştuğu saptanmıştır.

C3 karbon tutulumu mekanizması, fotosentezdeki karbon tutulumu mekanizmalarından biridir.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.

Gibbs serbest enerjisi entalpiden, entropi ve mutlak sıcaklığın çarpımının çıkarılmasıyla elde edilen termodinamik bir değişkendir. Genel olarak kimyasal bir reaksiyonun enerji potansiyelinin işe dönüştürülebilmesiyle ilgilidir.

Cyril Norman Hinshelwood, İngiliz kimyager, Nikolay Semyonov ile birlikte 1956 yılı Nobel Kimya Ödülü sahibi akademisyen. Özellikle kimyasal tepkime mekanizmaları üzerine çalışmalarıyla tanınmıştır. Hidrojen'in yanması, oksijen'in su oluşturması gibi zincir tepkimelerin tepkime hızı ve mekanizmaları üzerine araştırmalar yapmıştır. Son dönem araştırmaları daha sonra antibiyotik araştırmalarında kullanılacak bakteriyel hücre duvarlarında meydana gelen kimyasal değişiklikler üzerine olmuştur.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.
Fischer-Tropsch reaksiyonu, Alman kimyagerler Franz Fischer ve Hans Tropsch tarafından bulunan doğal gazları sıvıya dönüştürme işlemini yapan tepkimedir. Sanayi kullanımında katı ve gaz yakıtları sıvıya çevirmede kullanılmaktadır. Biyoloji alanında ise yağların yapı taşı olan karboksillerin oluşumunu açıklamak için kullanılır. Karboksil, Fischer-Tropsch Tepkimesi ile bir dizi kimyasal tepkime, demir sülfür ve bakır sülfür kimyasallarından yola çıkarak, metan, karbondioksit ve hidrojen gazların katılımıyla oluşur. Fischer-Tropsch Tepkimesinin en uygun sıcaklık aralığı 150-300 °C (302-572 °F) arasındadır.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.
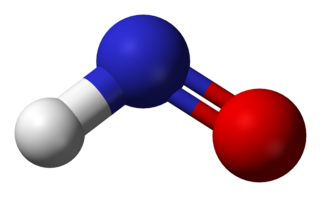
Nitroksil veya azanon, HNO kimyasal bileşiğidir. Gaz fazında iyi bilinmektedir. NO− İndirgenmiş nitrik oksit formudur (NO) ve dioksijen ile izoelektroniktir. Nitroksil, bir reaksiyon ara maddesi olarak oluşturulabilir.
Reaksiyon kinetiği olarak da bilinen kimyasal kinetik, kimyasal reaksiyonların hızlarını ve mekanizmalarını araştırmakla ilgilenen bir fiziksel kimya dalıdır. Bir sürecin gerçekleştiği yön ile ilgilenen ancak gerçekleşme hızları hakkında bir bilgi vermeyen termodinamik ile karıştırılmamalıdır. Kimyasal kinetik, deneysel koşulların kimyasal reaksiyonların hızı üzerine etkilerini, reaksiyon mekanizmaları ile geçiş hâllerinin verim bilgilerini ve kimyasal reaksiyonların karakteristiklerini tanımlayan matematiksel modellerin çıkarılmasını kapsayan bir bilim alanıdır.

Kimyasal reaksiyon mühendisliği, kimya mühendisliği ve endüstriyel kimya alanında kullanılan kimyasal reaktörler ve tepkime kinetiği ile ilgilenen bir uzmanlık alanıdır. Tepkime kinetiği ve reaktör tasarımını birleştiren kimyasal reaksiyon mühendisliği, birçok endüstriyel kimyasalın üretimi için gerekli temel bir unsurdur. Kimyasal reaksiyon mühendisliği disiplininin günlük hayatta pek çok uygulama alanı bulunur. Kimyasal üretimi, ilaç üretimi ve atık arıtımı faaliyetlerinde reaksiyon mühendisliği kullanılır. Enzim kinetiği, farmakokinetik, ısı etkileri, ani reaksiyonlar ve tesis güvenliği gibi konularda da kimyasal reaksiyon mühendisliği disiplininden faydalanılır. Kimyasal reaksiyon mühendisliği ilk kez 1940'lar ve 1950'lerde hızla büyüyen kimya ve petrokimya sanayisinin ihtiyaçlarını karşılamak için ortaya çıkmış ve günümüze kadar plastiklerin, kimyasalların, ilaçların ve diğer pek çok maddenin üretim süreçlerinde kullanılan bir yöntem olmuştur.
















