Klasik mekanikte momentum ya da devinirlik, bir nesnenin kütlesi ve hızının çarpımıdır; (p = mv). Hız gibi, momentum da vektörel bir niceliktir, yani büyüklüğünün yanı sıra bir yöne de sahiptir. Momentum korunumlu bir niceliktir ; yani bu, eğer kapalı bir sistem herhangi bir dış kuvvetin etkisi altında değilse, o kapalı sistemin toplam momentumunun değişemeyeceği anlamına gelir. Momentum benzer bir konu olan açısal momentum ile karışmasın diye, bazen çizgisel momentum olarak da anılır.

Radyoaktivite, radyoaktiflik, ışınetkinlik veya nükleer bozunma; atom çekirdeğinin, daha küçük çekirdekler veya elektromanyetik ışımalar yayarak kendiliğinden parçalanmasıdır. Çekirdek tepkimesi sırasında veya çekirdeğin bozunması ile ortaya çıkar. En yaygın ışımalar alfa(α), beta(β) ve gamma(γ) ışımalarıdır. Bir maddenin radyoaktivitesi bekerel veya curie ile ölçülür.
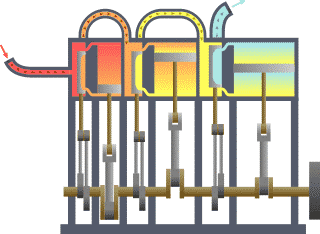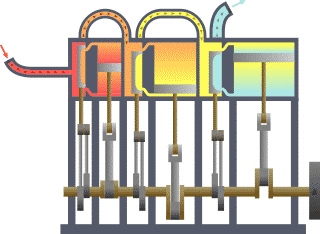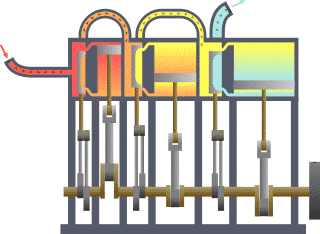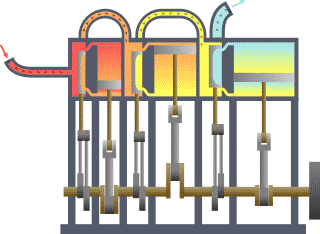
Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.
Kimyasal denge, iki yönlü bir tepkimede ürünlerin meydana geliş hızının, ürünlerden tekrar tepkimeye girenlerin meydana geliş hızına eşit olduğu durumdur. Böyle denklemlerde tepkimenin her iki tarafa olabileceğini göstermek için çift yönlü ok  kullanılır. Genel olarak şöyle göstermek mümkündür:
kullanılır. Genel olarak şöyle göstermek mümkündür:

Benzinli motorda, yanma sabit hacimde gerçekleşir, dizel motorda ise yanma sabit basınçta gerçekleşir. Karma çevrimde ise günümüz modern dizel motorlarında olduğu gibi, yanmanın ilk aşaması sabit hacime yakın, son aşaması ise sabit basınca yakın gerçekleşmektedir. Bu yüzden ısının bir miktarının sabit hacimde, geri kalan kısmının da sabit basınçta sisteme verildiği bu çevrime karma çevrim denir.
Hidrojenasyon, bir kimyasal reaksiyon sınıfıdır ve organik bileşiklere hidrojen (H2) eklenmesi işlemidir. Hidrojenasyon, özellikle doymamış organik bileşikler (alkenler, alkinler, ketonlar ve nitriller ) için önemli bir reaksiyondur. Genellikle basınç altında katalizörler yardımı ile direkt hidrojen eklemesi ile gerçekleştirilir. Hidrojenasyon için en klasik örnek, alkenlerdeki doymamış karbon kimyasal bağına bir hidrojenin ekleyerek, alkeni alkana dönüştürmektir. İlaç ve petrokimya endüstrisinde çok değişik uygulamaları vardır. Bu kimyasal işlemin tersi dehidrojenasyondur. Alkenlere hidrojenin katılması sonucunda Alkanlar oluşur. Alkankar sadece karbon-karbon tekli bağlara sahiptirler. Bu tepkimede katalizör kullanıldığından katalitik hidrojenleme olarak da adlandırılır. Alkenlere hidrojen katılma tepkimeleri ekzotermik tepkimeler olup oda sıcaklığında katalizörsüz tepkime gerçekleşmez. Burada katalizör kullanılarak tepkimenin oda sıcaklığında gerçekleşmesi sağlanır. Yalnız katalizörün etkisi bununla sınırlı kalmıyor. Kullanılan katalizör elde edilecek olan ürünün cis-Alkan ya da trans-Alkan olmasını etkilemektedir. Eğer kullanılan katalizör heterojen bir katalizör ise, (bir parça nikel, platin, paladyum) yani çözelti içerisinde heterojen olarak karışıyorsa katılan her iki hidrojen atomu alkenin aynı tarafına eklenir ve böylece cis-Alkan oluşur. Şayet bu katalizör çözelti içerisinde homojen olarak yayılan bir katalkizörse bu seferde trans-Alkan oluşmuş olacak.

Navier-Stokes denklemleri, ismini Claude-Louis Navier ve George Gabriel Stokes'tan almış olan, sıvılar ve gazlar gibi akışkanların hareketini tanımlamaya yarayan bir dizi denklemden oluşmaktadır.
Sabit hacim çevrimleri, buji ile ateşlemeli motorlarda kullanılan, ateşlemenin piston üst ölü noktaya geldiği ve sıkıştırma sonu basıncının en üst seviyeye çıktığı anda bujilerden kıvılcım çaktırılarak yapılan bunun sonucunda da pistonu aşağıya iten maksimum basıncın elde edildiği çevrimlerdir. Sabit basınç ya da dizel çevrimlerinden farkı ateşleme sabit bir hacimde yapılması ve buji kullanılmasıdır. Sabit hacim derken, dizel çevrimlerinde olduğu gibi piston aşağıya doğru inerken sisteme ısı girişi yapılmamaktadır.

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.

Gibbs serbest enerjisi entalpiden, entropi ve mutlak sıcaklığın çarpımının çıkarılmasıyla elde edilen termodinamik bir değişkendir. Genel olarak kimyasal bir reaksiyonun enerji potansiyelinin işe dönüştürülebilmesiyle ilgilidir.
Kimyada kimyasal enerji, pil, ampul ve hücre gibi bir kimyasal maddenin tepkime esnasındaki değişiminin potansiyelidir. Kimyasal bağ kurma veya koparma sonucu enerji açığa çıkar. Bu enerji bir kimyasal sistem tarafından ya emilir ya da yayılır.
18. yy. ve sonrasında geliştirilmiş, genellikle vektörel mekanik olarak nitelendirilen ve orijinalinde Newton mekaniği olarak bilinen analitik mekanik, klasik mekaniğin matematiksel fizik kaynaklarıdır. Model harekete göre analitik mekanik, Newton’un vektörel enerjisinin yerine, hareketin iki skaler özelliği olan kinetik enerjiyi ve potansiyel enerjiyi kullanır. Bir vektör, yön ve nicelik ile temsil edilirken bir skaler, nicelik ile(yoğunluğu belirtirken) temsil edilir. Özellikle Lagrange mekaniği ve Hamilton mekaniği gibi analitik mekanik de, sorunları çözmek için bir sistemin kısıtlamalarının ve tamamlayıcı yollarının kavramını kullanarak klasik mekaniğin kullanım alanını etkili bir şekilde yapılandırır. Schrödinger, Dirac, Heisenberg ve Feynman gibi kuram fizikçileri bu kavramları kullanarak kuantum fiziğini ve onun alt başlığı olan kuantum alan teorisini geliştirdiler. Uygulamalar ve eklemelerle, Einstein’a ait kaos teorisine ve izafiyet teorisine ulaşmışlardır. Analitik mekaniğin çok bilindik bir sonucu, modern teorik fiziğin çoğunu kaplayan Noether teoremidir.
Matematiksel fizikte, hareket denklemleri, fiziksel sistemin hareket sürecindeki davranışını, zamanın bir fonksiyonu olarak tanımlar. Daha detaya girmek gerekirse; hareket denklemleri, fiziksel sistemin davranışını devinimsel değişkenler üzerinde tanımlanmış bir matematiksel fonksiyon takımı olarak izah eder. Bu değişkenler genellikle uzay koordinatları ve zamandan ibarettir, ama gerektiğinde momentum bileşenleri de kullanılır. En yaygın değişken seçeneği, fiziksel sistemin özelliklerini uygun şekilde tanımlayan değişkenlerden oluşan genelleştirilmiş koordinatlardır. Klasik mekanikte bu fonksiyonlar öklid uzayında tanımlanmıştır ama görelilikte eğilmiş uzay üzerindeki fonksiyon daha uygundur. Eğer sistemin dinamikleri biliniyor ise, bu fonksiyonları tanımlayan denklemler dinamiğin hareketini izah eden diferansiyel denklemlerin çözümleri olacaktır.

Roket motoru, genellikle yüksek sıcaklıktaki gaz olan yüksek hızlı itici bir sıvı jeti oluşturmak için tepkime kütlesi olarak depolanmış roket itici gazlarını kullanır. Roket motorları, Newton'un üçüncü yasasına göre kütleyi geriye doğru fırlatarak itme üreten tepki motorlarıdır. Çoğu roket motoru, gerekli enerjiyi sağlamak için reaktif kimyasalların yanmasını kullanır, ancak soğuk gaz iticileri ve nükleer termal roketler gibi yanmayan biçimleri de mevcuttur. Roket motorları tarafından tahrik edilen araçlara genellikle roket denir. Roket araçları, çoğu yanmalı motorun aksine kendi yükseltgen taşır, bu nedenle roket motorları, uzay aracını ve balistik füzeleri itmek için bir boşlukta kullanılabilir.

Lagrange mekaniği, klasik mekaniğin yeniden formüle edilmesidir. İtalyan-Fransız matematikçi ve astronom Joseph-Louis Lagrange tarafından 1788’de geliştirilmiştir.
Reaksiyon kinetiği olarak da bilinen kimyasal kinetik, kimyasal reaksiyonların hızlarını ve mekanizmalarını araştırmakla ilgilenen bir fiziksel kimya dalıdır. Bir sürecin gerçekleştiği yön ile ilgilenen ancak gerçekleşme hızları hakkında bir bilgi vermeyen termodinamik ile karıştırılmamalıdır. Kimyasal kinetik, deneysel koşulların kimyasal reaksiyonların hızı üzerine etkilerini, reaksiyon mekanizmaları ile geçiş hâllerinin verim bilgilerini ve kimyasal reaksiyonların karakteristiklerini tanımlayan matematiksel modellerin çıkarılmasını kapsayan bir bilim alanıdır.

Kimyasal reaktörler bir kimyasal reaksiyonun gerçekleştirildiği proses ekipmanlarıdır. Kimya mühendisliğinde proses tasarımı ve analizinde sık kullanılan klasik bir ünite prosesidir. Bir kimyasal reaktörün tasarımı, kimya mühendisliğinin birden fazla unsurunun kullanılmasını gerektirir. Reaktörler proseste ham maddelerin ürünlere dönüştüğü oldukça temel bir ekipman olduğundan proses tasarımı açısından büyük önem arz eder. Kimya mühendisleri bir reaksiyonun net bugünkü değerini en üst düzeye çıkarmak için reaktörler tasarlar. Tasarımcılar satın alma ve işletme maliyetini en düşük seviyelerde tutarken bir yandan da üretilen ürün miktarını en yüksek seviyede tutmak için reaksiyonun ürünler yönünde mümkün olan en yüksek verimle devamlılığını sağlarlar. Enerji girişi, enerji çıkışı, ham madde maliyetleri, işçilik vb. işletme giderlerine örnek olarak verilebilir. Isıtma, soğutma, basıncı artırmak için pompalama, sürtünmeden kaynaklı basınç düşüşü ve çöktürme gibi durumlar da enerji değişimlerine birer örnektir.
Kimyasal tepkimelerde giren ve ürünün derişimlerinin sabit olması durumuna kimyasal denge olarak adlandırılmaktadır.
Elektrokimyada Nernst denklemi, bir elektrokimyasal reaksiyonun indirgenme potansiyelini ; indirgeme ve oksidasyona uğrayan kimyasal türlerin standart elektrot potansiyeli, sıcaklığı ve aktiflikleri ile ilişkilendiren bir denklemdir. Denklemi formüle eden Alman fiziksel kimyacı Walther Nernst'in adını almıştır.


![{\displaystyle r=-{\frac {1}{a}}{\frac {d[A]}{dt}}=-{\frac {1}{b}}{\frac {d[B]}{dt}}={\frac {1}{p}}{\frac {d[P]}{dt}}={\frac {1}{q}}{\frac {d[Q]}{dt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f080c89a409f936f55500b3a0d405dcbdcd35b7b)
![{\displaystyle \,r=k[A]^{n}[B]^{m}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/697e4c82e7702c08ba5ce09199d220424ccd0d6e)








