Protein birincil yapısı

Peptit ve proteinlerin birincil yapısı, bu moleküllerin yapı birimleri olan amino asitlerin doğrusal sırası veya daha genel olarak, bir proteini oluşturan atomlar arasındaki kovalent bağların spesifikasyonudur.
Tanım
Protein yapısını birincil, ikincil ve üçüncül olarak ayrılması 1951'de Kaj Ulrik Linderstrøm-Lang tarafından önerilmiştir. Linderstrøm-Lang, proteinin katlanmamış yapısına birincil yapı, protein zincileri arasında iç bağlantılar oluşması sonucu oluşan sarmallara ikincil yapı, bu sarmallar arasında oluşan bağlantılar sonucu oluşan yapıya üçüncül yapı olarak değinmiştir.[1] Bu tanımlama olduça genel olduğu için eleştirilmiş[2] bu yüzden 1969'da IUPAC-IUB Biyokimyasal Adlandırma Kuralı Komisyonu, Kaj Ulrik Linderstrøm-Lang'ın tanımlamasının yeterince kesin olmadığını belirterek, birincil yapıyı "polipeptit zincirdeki amino asit dizisi" olarak tanımlanmasını önermiş ve bu tanımın "kovalent yapı" tanımından farklı olduğunu ve disülfür bağları kapsamadığını eklemiştir.[3] Buna rağmen çoğu araştırmacı birincil yapıyı proteinin kovalent yapısı ile eş anlamlı saymaya devam etmiştir,[4][5] ve günümüz ders kitaplarında birincil yapının amino asit diziden oluştuğunu ve disülfür bağlarını da kapsadığı belirtilemeye devam eder.[6]
Tipik, disülfür bağları içermeyen, dallanmamış bir protein için onun kovalent yapısı, amino asit dizisine eşdeğerdir. Birincil yapının kovalent yapıya karşılık geldiği varsayılırsa, bir proteinin birincil yapısı onun atomik bileşiminin ve bu atomları birleştiren bağların (sterokimyasal özellikleri de dahil olmak üzere) spesifikasyonudur.
İkinci ve üçüncül yapı ile ilişki
Bir proteinin birincil yapısı onun "üçüncül yapısı" olarak adlandırılan üç boyutlu yapısını büyük oranda belirler. Ancak, protein katlanması o kadar karmaşıktır ki, birincil yapıyı bilmek, proteinin ne şeklini, ne de yerel yapı elemanlarının yapılarını (sarmallar veya dönmeler gibi) öngörmeye yeter. Homolog diziye sahip olan başka proteinlerin (örneğin bir protein ailesinin diğer üyelerinin) yapısını bilmek, belli bir dizinin üç boyutlu yapısının oldukça güvenli şekilde hesaplanmasını mümkün kılar. Dizi aileleri dizi hizalaması yoluyla belirlenirler.
Kimyasal yapı
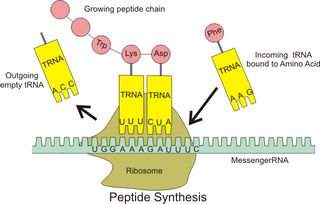
Proteinler genelde yirmi doğal amino asitin birbiriyle peptit bağları kurarak oluşturduğu polimerlerdir. Polimeri oluşturan birimlere amino asit kalıntısı (rezidü) denir. Proteinler "omurga" tabir edilen, düzenli tekrarlayan bir peptit "omurga" ve bu omurgaya bağlı farklı amino asit yan zincirlerinden oluşur. Bazı proteinlerde bu yan zincirler kimyasal değişime uğrayabilirler. Bazı yan zincirler arasında çapraz bağlar oluşabilir, bazılarına ise enzimler aracılığıyla farklı fonksiyonel gruplar eklenebilir (bakınız aşağıdaki #Kovalent değişimler bölümü).
Polipeptit zincirler yönlüdür, çünkü uçları farklıdır. Konvansiyon gereği, bir proteinin birincil yapısı onun amino (N) ucundan karboksi (C) ucuna doğru belirtilir.
Önemi
Bir proteinin birincil yapısının bilinmesinin çeşitli faydaları vardır:[7]
- Bir proteinin amino asit dizisi diğer tüm bilinen dizilerle karşılaştırılarak önemli benzerlikler olup olmadığına bakılabilir.
- Aynı proteinin farklı organizmalardaki örnekleri karşılaştırılarak evrimsel ilişkiler anlaşılabilir.
- Proteinin hücre içinde nerede bulunacağını belirleyen sinyal dizilerin varlığına bakılabilir.
- Proteine bağlanacak bir antikor hazırlanmasında kullanılabilecek bir peptit hazırlanabilir.
- Proteini kodlayan genin bulunmasına yarayacak DNA probları tasarlanabilir.
Belirlenmesi
Proteinlerdeki amino asit dizisi DNA tarafından kodlandığı için, bir protein geninin dizisinin belirlenmesi o proteini oluşturan amino asit dizisinin belirlenmesini sağlar. Günümüzde çoğu proteinin birincil yapısı o proteinin gen dizisine dayalıdır. Ancak, DNA dizisinin genetik kod kullanılarak amino asit dizisine çevrilmesi, proteinin gerçek birincil yapısını sağlamaya yeterli değildir. Eğer proteinde disülfür bağları varsa bunların hangi sisteinler arasında olduğu DNA dizisinden anlaşılamaz. Keza, eğer proteinde çevrim sonrası bir kimyasal modifikasyon varsa (fosforilasyon veya glikozilasyon gibi), bunlar da DNA dizisinden anlaşılamaz. Bu yüzden bir proteinin birincil yapısının çözülmesi için onun doğrudan analiz edilmesi gerekir.
Bir proteinin birincil yapısının çözülmesinin ilk adımı onun amino asit bileşiminin belirlenmesidir. Edman yıkımı, proteinin N-ucundan bir amino asit kalıntısının çıkartılmasını sağlar. Bu işlem tekrar tekrar yapılarak proetinin dizisi N-uçtan içeri doğru teker teker okunabilir. Otomatik dizileme makinaları bir proteinin yaklaşık 50 amino asitlik bir kısmını okuyabilirler. Analizi kolaylaştırmak için, büyük proteinler kimyasal veya enzimatik yolla 50 kalıntıdan daha kısa parçalara bölünürler, bunlar ayrı ayrı dizilenmesinden tam proteinin dizisi elde edilebilir.
Bir proteinin birincil yapısının tam anlaşılması için disülfür bağlarının yerlerinin de belirlenmesi gerekir. Protein küçük peptitlere bölündükten sonra bu peptitler elektroforez veya kromatografik yöntemle ayrıştırılırlar. Numuneler, bir kere normal halleriyle, bir kere de disülfür bağlarının indirgenmesine yol açacak şartlar altında analiz edilir. Farklı hareket eden peptitlerin protein içinde disülfür bağı ile birbirine bağlı olduğu bu yolla anlaşılabilir.
Günümüzde kütle spektometresi, protein birincil yapısının çözülmesinde kullanılan önemli bir yöntem olmuştur. Bu yöntemle moleküllerin toplam kütlesi büyük hassasiyetle ölçülülebilir. Tripsin gibi bir proteaz kullanılarak bir proteindaha küçük parçalara bölünürse, parçaların gözlemlenen kütleleri ile DNA dizisinden beklenen kütleleri arasındaki fark, o peptit parçasında hangi kimyasal değişimin olduğuna belirlemeye yarar.
Kovalent değişimler
Genelde polipeptitler dallanmayan polimerlerdir, bu yüzden birincil yapıları genelde onları oluşturan amino asitlerin dizisi şeklinde ifade edilebilir. Ancak, proteinler çapraz bağlanabilirler. Bunun en sık görülen şekli disülfür bağları iledir ve birincil yapıda çapraz bağlanan atomların (protein disülfür bağlarını meydana getiren sisteinlerin) da belirtilmesi de gerekebilir.
Polipeptit zincirdeki kiral merkezler rasemizasyona uğrayabilirler. özellikle, proteinlerde bulunan L-amino asitler bazen spontan olarak atomunda izomerize olup D-amino asitlere dönüşebilirler.
Ayrıca, proteinler çevrim sonrası değişimlere uğrayabilirler, bunlar aşağıda kısaca özetlenmiştir.
Uçlarda değişimler
Bir polipeptidin N-ucundaki amino grubu kovalent olarak aşağıdaki değişimlerden birine uğrayabilir
- asetilasyon

- N-uçtaki amino grubu bir asetil grubuna dönüştürülerek bu ucun pozitif yükü yok edilebilir (N-uç bloklaması).
- formilasyon
- N-uçtaki metiyonin'in N-ucu, genelde çevrimin hemen ardından bir formil grubu ile bloke olur. Bu formil grubu (ve bazen metiyonin kalıntısının kendisi de, eğer bir Gly veya Ser tarafından izleniyorsa) deformilaz enzimi tarafından çıkarılır.
- piroglutamat

- N-uçtaki bir glutamat kendi kendisine saldırarak bir siklik (dairesel) piroglutamat grubu oluşturabilir.
- miristoylasyon
- Asetilasyona benzer ama basit bir metil grubu yerine, 14 karbonlu bir hidrokarbon zincir (miristik asit) bağlanır. Bunun sayesinde protein hücre zarına sabitlenir.
Bir polipeptit zincirin C-ucundaki karboksilat grubu da değişime uğrayabilir. Örneğin,

- amidasyon (Şekle bakınız)
- C-uçtaki negatif yük, amidasyon yoluyla yok edilebilir.
- glikosil fosfatidilinositol (GPI) bağlantısı
- Glikosil fosfatidilinositol büyük, hidrofobik bir fosfolipit gruptur, proteinleri hücre zarına sabitler. Polipeptidin C-ucuna bir amit bağı ile bağlanır, bu amit bağının öbür ucunda bir etanolamin, sonra çeşitli şekerler ve nihayet bir fosfatidil inositol grubu bulunur.
Yan zincir değişimleri
Peptidin yan zincirleri de kovalent olarak değişime uğrayabilir:
- fosforilasyon
- Protein zincirinin kesilmesinden sonra gelen en önemli değişim fosforilasyon sayılabilir. Serin, treonin ve tirozin kalıntılarının yan zincir hidroksil grubuna bir fosfat grubu bağlanabilir. Bunun sonucu olarak orada bir negatif yük meydana gelir. Bu reaksiyonlar kinaz enzimleri tarafından, bu fosfatların çıkarılması reaksiyonu ise fosforilaz enzimleri tarafından katalizlenir. Fosforile olmuş tirozinler proteinlerin birbirine bağlanmasını sağlayan tutacaklar gibi işlev görürler. Serin (Ser) ve treonin (Thr) fosforilasyonu ise genelde konformasyonal değişime yol açar, muhtemelen proteine katılan eksi yükün etkisinden dolayı. Ser/Thr'nin fosforile olmasında görülen etkiler bazen o amino asidin mutasyon yoluyla glutamata dönüştürülmesi ile de görülebilir.
- Bu terim, sık görülen ama oldukça heterojen bir değişimler grubuna toplu olarak değinmek için kullanılır. Ser/Thr'nin yan zincir hidroksil grubuna veya Asn'nin yan zincir amino grubuna karbonhidrat grupları bağlanabilir. Bu şekerli bağlantılar pek çok işleve sahip olabilir, proteinin daha iyi çözünmesini sağlamaktan, bağlanıp beraber kompleks oluşturulacak başka bir proteini tanımaya kadar. Tunikamisin gibi bazı inhibitörler glikozilasyon reaksiyonlarını bloke edebilir.
- deamidasyon (süksinimit oluşumu)
- Bu değişimde, bir asparajin veya aspartat yan zinciri, kendisini izleyen peptit bağına saldırarak simetrik bir süksinimit araürünü oluşturur. Bu araürünün hidrolizi sonucu aspartat veya, bir β-amino asit olan, izo(Asp) meydana gelir. Asparajin durumunda, her iki ürün de amit grubunun kaybı sonucunu doğurur, bu yüzden bu reaksiyona "deamidasyon" denir.
- hidroksilasyon
- Prolin kalıntılarındaki iki atomdan biri ve lizindeki bir atom hidroksile olabilir. Hidroksiprolin, kollajenin önemli bir parçasıdır, onun eksilmesi üzerine kollajen kararsız hâle gelir. Hidroksilasyon reaksiyonunu katalizleyen enzimler (prolil hidroksilaz and lizil hidroksilaz) askorbik aside (C vitamini) gereksinim duyduğu için, bu vitaminin eksikliği iskorbüt gibi çeşitli bağ dokusu hastalıklarına neden olur.
- Proteinlerdeki bazı amino asit kalıntıları metilasyona uğrayabilir, bunların başlıcaları lizin ve arjinindir. Bunların metilasyonu genelde proteinlerin nükleik asitlere bağlanmasını düzenlemeye yarar. Lizin kalıntıları tekli, ikili ve üçlü metile olabilirler. Ancak, metilasyon bu yan zincirlerin pozitif yükünü değiştirmez.
- Lizin amino gruplarının asetilasyonu, N-uçtaki amino grubunun asetilasyonu gibidir. Ancak, işlevsel olarak, lizinlerin asetilasyonu genelde proteinlerin nükleik asitlerie bağlanmasını düzenlemeye yarar. Lizindeki pozitif yükün yok edilmesi, negatif yüklü nükleik asitlere olan elektrostatik çekimi azaltır.
- sülfasyon
- Tirozinler atomlarından sülfatlanabilirler. Bu değişim Golgi cisminde görülür ama endoplazmik retikulumda görülmez. Fosforile olmuş tirozinlere benzer şekilde, sülfat grubu taşıya tirozinler spesifik protein tanımasına yararlar, örneğin, hücre yüzeyindeki kemokin reseptörlerine. Fosforilasyonda olduğu gibi, sülfasyon da önceden nötür bir konumun negatif yüklü olmasına neden olur.
- prenilasyon ve palmitoylasyon
Hidrofobik izopren (örneğin farnesil, jeranil ve jeraniljeranil grupları) ve palmitoyl grupları, sistein kalıntılarındaki atomlarına bağlanarak proteinlerin hücre zarında sabitlenmesine yararlar. GPI ve miristoyl gruplarından farklı olarak, bu gruplar sadece proteinin bir ucuna takılmazlar.
- karboksilasyon
- Nispeten ender görülen bir değişim olan karboksilasyonda, bir glutamat yan zincirine ikinci bir glutamat (ve dolayısıyla ikinci bir eksi yük) eklenir. Bunun sonucu bir Gama-karboksiglutamik asit (Gla) kalıntısı meydana gelir. Bu değişim, kalsiyum gibi metal iyonlarına olan bağlanmanın kuvvetlenesini sağlar.
- ADP-ribozilasyon
- ADP-ribozil grubu proteinlerde çeşitli yaz zincirlerlere takılabilir, bunlar çeşitli farklı sonuçlar doğrurur. Vibrio cholerae, Corynebacterium diphtheriae ve Bordetella pertussis gibi bazı bakterilerin salgıladığı kuvvetli toksinler bu yolla hedef proteinlerini çalışmaz hâle getirirler.
- ubikuitinasyon ve SUMOylasyon
- Bazı proteinlerdeki lizinlerin amino gruplarına, çeşitli, başka, tam uzunlukta proteinler bağlanabilir. Bunların en yaygını ubikuitindir ve genelde ubikuitin bağlanmış proteinin yıkıma uğraması gerektiğini sinyaller.
Yukarıda belirtilen polipeptit değişimlerinin çoğu çevrim sonrası, yani protein ribozomda sentezlendikten sonra, meydana gelir. Bu değişimler ökaryotik hücrelerde tipik olarak endoplazmik retikulumda meydana gelir.
Kimyacılar proteinlere başka kimyasal reaksiyonlar uygulamıştır, siyanilasyon gibi, ama bunlar biyolojik sistemlerde görülmez.
Birincil yapıda kesilmeler
Yukarıda listelenen değişimlerden başka, birincil yapıda meydana gelen önemli değişim peptit kesilmesidir. Çoğu protein inaktif bir prekürsör (öncül) olarak sentezlenir. Tipik olarak N-uçta veya C-uçta bir peptit parçası proteinin aktif bölgesini bloke eder ve fonksiyonunu inhibe eder. İnhibe edici peptit bir proteaz tarafından kesilince protein aktive olur.
Bazı proteinler kendi kendilerini kesme yeteneğine sahiptir. Tipik olarak, bir serin'in (ve daha ender olarak bir treonin'in) hidroksil grubu veya bir sistein'in tiyol grubu, kendisinden önce gelen peptit bağındaki karbonil grubuna saldırır. Bunun sonucu tetrahedral bağlı bir araürün oluşur (Ser/Thr durumunda hidroksioksazolidin, cys durumunda hidroksitiyazolidin araürün olarak adlandırılır). Bu araürün amit biçime geri dönme eğilimlidir ve saldırıcı grubu atar, çünkü peptit grubunun kuvvetli rezonans stabilizasyonu nedeniyle amit biçim enerjik olarak daha tercihlidir. Ancak, diğer moleküler etkileşimler amit biçimi daha az karralı kılabilir, bu durumda amino grup atılır ve peptit bağı yerine bir ester (Ser/Thr) veya tiyoester (Cys) bağı oluşur. Bu kimyasal reaksiyon N-O asil kayması olarak adlandırılır.[8]
Ester/tiyoester bağı aşağıdaki birkaç yoldan biri ile kopar:
- Basit hidroliz polipeptit zincirini keser, atılan amino grup yeni N-uç olur. Glikosilarjinaz'ın olgunlaşmasında bu mekanizma görülür.
- Bir β-eliminasyon reaksiyonu da zinciri keser, ama yeni N-uçta bir piruvoyl grubu meydana getirir. Bu piruvoyl grubu bazı enzimlerde kovalent bağlı bir katalitik kofaktör olarak kullanılır. S-adenozilmetyonin dekarboksilaz gibi bazı dekarboksilazlar, piruvoyl grubunun elektron çekici gücünü kullanırlar.
- Molekül-içi (intramoleküler) transesterifikasyon sonucu dallı bir polipeptit meydana gelir. İnteinlerde, yeni ester bağı, yeni C-uçta yer alacak olan asparajin tarafından intramoleküler bir saldırıyla kesilir.[9][10]
- Moleküller arası (intermoleküler) transesterifikasyon ile proteinin bir parçası bir diğer proteine aktarılır, Hedgehog proteinin özişlemlemesinde görüldüğü gibi.
Protein birincil yapısının tarihi
Fransız kimyacı Louis Édouard Grimaux proteinlerin amit bağları içerdiğini 1882'de öne sürmüştü. Proteinlerin α-amino asitlerden oluşan zincirler olduğu, 1902'de, neredeyse aynı zamanda, Karlsbad'da düzenlenen Alman Bilim İnsanları ve Hekimler Derneğinin 74. toplantısında iki bilim insanı tarafından önerildi. Sabah, önce Franz Hofmeister, proteinlerdeki biuret reaksiyonu üzerindeki gözlemlerine dayanarak bu görüşü ortaya attı.[11] Birkaç saat sonra, peptit bağı hakkında muazzam kimyasal bilgi biriktirmiş olan Emil Fischer onu izledi.[12]
Bu verilere ve proteolitik yıkıma uğrayan proteinlerin sadece oligopeptit ürün verdiğine dair kanıtlara rağmen, proteinlerin amino asitlerden meydan gelmiş, doğrusal, dalsız polimerler olduğu fikri hemen kabul görmedi. William Astbury gibi bazı saygın bilim insanları kovalent bağların bu kadar uzun molekülleri bir arada tutabilecek kadar güçlü olabileceğini şüpheyle karşılıyorlardı. Termal titreşimlerin proteinin dağılmasına yol açabileceğini düşünüyorlardı. 1920'lerde kauçuğun makromoleküllerden olşutuğunu öne süren Hermann Staudinger de benzeri önyargılarla karşı kaşıya kalmıştı.[13]
Bu şüpheler yüzünden alternatif hipotezler öne sürüldü. Kolloidal protein hipotezi proteinlerin daha küçük proteinlerden oluşan kolloid birleşimler olduğuydu. 1920'lerde Theodor Svedberg tarafından yapılan ultrasantrifügasyon ölçümleri proteinlerin kesin ve tekrarlanabilir bir molekül ağırlığına sahip olduğunu, ardından Arne Tiselius'un elektroforetik ölçümleri proteinlerin tekil moleküller olduğunu gösterince, bu hipotez çürütüldü. İkinci bir hipotez, Dorothy Wrinch tarafından öne sürülen siklol hipotezi idi. Bu hipoteze göre, doğrusal polipeptit, kimyasal bir siklol yeniden düzenlemesine (C=O + HN C(OH)-N ) uğramakta ve omurga amit grupları çapraz bağlanmaktaydı, böylece iki boyutlu bir doku meydana gelmekteydi. Proteinler için başka birinci yapılar da önerildi, örneğin, Emil Abderhalden'in diketopiperazin modeli ve Troensegaard'ın 1942'deki pirol/piperidin modeli.[14] Nihayet, Frederick Sanger'in insülin'in dizisini çözmesi;[15] ve Max Perutz ve John Kendrew'ün miyoglobin ve hemoglobin'in kristalografik yapısını çözmesi ile, öne sürülen alternatif modellerin hepsi çürütülmüş oldu.
"Birincil yapı" terimi 1951'de Linderstrøm-Lang tarafından ilk defa kullanılmıştır.
Ayrıca bakınız
- Protein dizilemesi
- Translasyon
Kaynakça
- Wieland T and Bodanszky M (1991) The World of Peptides, Springer Verlag. ISBN 0-387-52830-X
- ^ Kaj Ulrik Linderstrøm-Lang (1952). Lane Medical Lectures: Proteins and Enzymes. Stanford: Stanford University Press.
- ^ Wetlaufer, D.B. (1961). "Terminology of Protein Structure" (PDF). Nature. Cilt 190. s. 1113. Erişim tarihi: 22 Aralık 2011.
- ^ IUPAC-IUB Commission on Biochemical Nomenclature (1969). "Abbreviations and Symbols for the Description of the Conformation of Polypeptide Chains. Tentative Rules". 4 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Aralık 2011.
- ^ Charles R. Cantor, Paul Reinhard Schimmel (1980). The conformation of biological macromolecules. Macmillan.
- ^ Jane S. Richardson (1981). "The Anatomy and Taxonomy of Protein Structure". Adv Protein Chem. Cilt 34. s. 167-339. 12 Şubat 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Aralık 2011.
- ^ Albert L. Lehninger, David Lee Nelson, Michael M. Cox (2005). Principles of Biochemistry, Volume 1. Macmillan. ISBN 9780716743392.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry, 5th edition. New York: W H Freeman.
- ^ Iwai K and Ando T. (1967) "N O Acyl Rearrangement", Methods Enzymol., 11, 263-282.
- ^ Perler FB, Xu MQ and Paulus H. (1997) "Protein Splicing and autoproteolysis mechanisms", Curr. Opin. Chem. Biol., 1, 292-299.
- ^ Paulus H. "The chemical basis of protein splicing", Chem. Soc. Rev., 27, 375-386.
- ^ Hofmeister F. (1902) Naturwiss. Rundschau, 17, 529-545.
- ^ Fischer E. (1902) Autoreferat. Chem. Ztg., 26, 93.
- ^ Fruton JS. (1979) "Early theories of protein structure", Ann. N.Y. Acad. Sci., 325, 1-18.
- ^ Troensegaard N. (1942) Über die Struktur des Proteinmoleküls: eine chemische Untersuchung. E. Munksgaard, København (Copenhagen).
- ^ Sanger F. (1952) "The arrangement of amino acids in proteins", Adv. Protein Chem., 7, 1-67