Protein agregasyonu

Protein agregasyonu, yanlış katlanmış proteinlerin hücre içinde veya dışında toplandığı biyolojik bir fenomendir.[1][2] Bu protein agregatları genellikle hastalıklar ile ilişkilidir. Aslında, protein agregatları, ALS, Alzheimer, Parkinson ve prion hastalıkları dahil olmak çok çeşitli hastalıklarda rol oynamaktadır.[3][4]
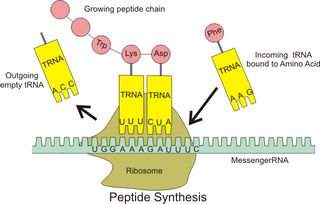
Sentezden sonra proteinler tipik olarak en termodinamik olarak uygun olan belirli bir üç boyutlu konformasyona (yani doğal durumları) katlanır.[5] Bu katlama işlemi hidrofobik etki tarafından yönlendirilir: proteinin hidrofobik (su sevmeyen) kısımları, proteinin iç kısmına gömülerek hücrenin hidrofilik (su seven) ortamından korunur. Böylece, bir proteinin dış kısmı tipik olarak hidrofilikken iç kısım tipik olarak hidrofobiktir.
Protein yapıları, iki sistein amino asiti arasındaki kovalent olmayan etkileşimler ve disülfür bağları ile stabilize edilir. Kovalent olmayan etkileşimler iyonik etkileşimleri ve zayıf van der waals etkileşimlerini içerir. İyonik etkileşimler bir anyon ve bir katyon arasında oluşur ve proteinin stabilize edilmesine yardımcı olan tuz köprülerini oluşturur. Van der waals etkileşimleri arasında polar olmayan etkileşimler (ör. London dispersiyon kuvvetleri ) ve polar etkileşimler (yani hidrojen bağları, dipol-dipol bağı) bulunur. Bunlar, bir alfa sarmalı veya beta tabakası gibi bir proteinin ikincil yapısında ve üçüncül yapısında önemli bir rol oynar. Bir proteindeki amino asitler arasındaki etkileşimler, o proteinin son yapısının belirlenmesinde çok önemli bir rol oynar.
Amino asit dizisindeki bir değişiklikle olabileceği gibi kovalent olmayan etkileşimlerde değişiklikler olduğunda da, protein yanlış katlanmaya veya açılmaya karşı hassastır. Bu durumlarda, hücre proteinin yeniden katlanmasına veya katlanmamış proteinin parçalanmasına yardımcı olmazsa, katlanmamış/yanlış katlanmış protein, kendisine ait açıkta kalan hidrofobik kısımlarının diğer proteinlerin açıkta kalan hidrofobik yamalarıyla etkileşime girmesi ile, agregatlar oluşturabilir.[6][7] Oluşabilecek üç ana protein agregat türü vardır: amorf agregatlar, oligomerler ve amiloid fibriller.[8]
Nedenler
Protein agregasyonu çeşitli nedenlerden dolayı ortaya çıkabilir. Bu nedenler kategorilere ayrılabilir, aşağıda detaylandırılan dört sınıf vardır.
Mutasyonlar
DNA dizisinde meydana gelen mutasyonlar proteinin amino asit dizisini etkileyebilir veya etkilemeyebilir. Sekans etkilendiğinde, farklı bir amino asit, proteinin katlanmasını etkileyen yan zincirler arasındaki etkileşimleri değiştirebilir. Bu durum proteinin yanlış katlanmasına veya katlanmamasına ve proteininin normalde iç kısımlarda gömülü olması gerekn hidrofobik kısımlarının açıkta kalmasına sebep olur. Açıkta kalan hidrofobik kısımlar, başka bir yanlış katlanmış veya katlanamamış proteinin hidrofobik kısımları ile etkileşerek proteinlerin birbirine kenetlenmesini ve yani agregat oluşumunu sağlayabilir. Alternatif olarak, gene açıkta kalan hidrofobik kısımlar, normal bir proteinin dış kısmındaki hidrofobik parçalar ile etkileşerek de agregat oluşumuna sebebiyet verebilir.
Etkilenen proteinlerin kendisindeki mutasyonlara ek olarak, protein agregasyonuna, yeniden katlanma yolu (moleküler şaperonlar) veya ubikitin-proteazom yolu (ubikitin ligazlar) gibi düzenleyici yolaklardaki proteinlerdeki mutasyonlar da neden olabilir.[9] Şaperonlar, proteinin katlanması için güvenli bir ortam sağlayarak proteinin yeniden katlanmasına yardımcı olur. Ubikitin ligazları, ubikitin modifikasyonu yoluyla degradasyon için proteinleri hedefler.
Protein sentezi ile ilgili sorunlar
Protein agregasyonu, transkripsiyon veya translasyon sırasında ortaya çıkan problemlerden kaynaklanabilir.[10] Bu işlemlerde problemler ortaya çıkarsa, bu proteinin yanlış bir şekilde katlanmasına ve protein agregasyonuna sebep olabilir.
Çevresel stresler
Aşırı sıcaklıklar ve pH veya oksidatif stres gibi çevresel stresler de protein agregasyonuna yol açabilir.[11]
Aşırı sıcaklıklar, amino asit kalıntıları arasındaki kovalent olmayan etkileşimleri zayıflatabilir ve dengesini bozabilir. Proteinin pH aralığının dışındaki pH'lar, amino asitlerin protonasyon durumunu değiştirebilir, bu da kovalent olmayan etkileşimleri artırabilir veya azaltabilir. Bu aynı zamanda daha az stabil etkileşimlere ve protein açılmasına neden olabilir.
Oksidatif stres, reaktif oksijen türleri gibi radikallerden kaynaklanabilir. Bu kararsız radikaller, amino asitlere saldırarak yan zincirlerin (örn. Aromatik yan zincirler, metiyonin yan zincirler) oksidasyonuna ve/veya polipeptit bağlarının yarılmasına yol açabilir.[12] Bu, proteini doğru bir şekilde bir arada tutan kovalent olmayan etkileşimleri etkileyebilir, bu da protein dengesizleşmesine neden olabilir ve proteinin açılmasına sebep olabilir.[11]
Yaşlanma
Hücreler, protein agregatlarını yeniden katlayabilen veya parçalayan mekanizmalara sahiptir. Bununla birlikte, hücreler yaşlandıkça, bu kontrol mekanizmaları zayıflar ve hücre, agregaları daha az çözebilir hale gelir.[11]
Kaynakça
- ^ Aguzzi (Mart 2010). "Protein aggregation diseases: pathogenicity and therapeutic perspectives". Nature Reviews Drug Discovery. 9 (3). ss. 237-48.
- ^ Stefani (Kasım 2003). "Protein aggregation and aggregate toxicity: new insights into protein folding, misfolding diseases and biological evolution". J Mol Med (Berl). 81 (11). ss. 678-99.
- ^ De Felice (Temmuz 2004). "Formation of amyloid aggregates from human lysozyme and its disease-associated variants using hydrostatic pressure". FASEB J. 18 (10). ss. 1099-101.
- ^ Tanzi (Şubat 2005). "Twenty years of the Alzheimer's disease amyloid hypothesis: a genetic perspective". Cell. 120 (4). ss. 545-55.
- ^ Brüning (1 Ocak 2015). "Misfolded proteins: from little villains to little helpers in the fight against cancer". Frontiers in Oncology. Cilt 5. s. 47.
- ^ Gething (Ocak 1992). "Protein folding in the cell". Nature. 355 (6355). ss. 33-45.
- ^ Roberts (Aralık 2007). "Non-native protein aggregation kinetics". Biotechnol Bioeng. 98 (5). ss. 927-38.
- ^ David L. Nelson; Michael M. Cox (21 Kasım 2012). Lehninger Principles of Biochemistry (İngilizce). W. H. Freeman. ISBN 978-1-4292-3414-6.
- ^ Berke (1 Haziran 2003). "Protein aggregation and the ubiquitin proteasome pathway: gaining the UPPer hand on neurodegeneration". Current Opinion in Genetics & Development. 13 (3). ss. 253-261.
- ^ Molecular Biology. ISBN 978-0-07-352532-7.
- ^ a b c Tyedmers (Kasım 2010). "Cellular strategies for controlling protein aggregation". Nature Reviews Molecular Cell Biology. 11 (11). ss. 777-788.
- ^ Stadtman (29 Temmuz 2003). "Free radical-mediated oxidation of free amino acids and amino acid residues in proteins". Amino Acids (İngilizce). 25 (3–4). ss. 207-218.