
Geçiş metalleri veya bazı kimyacıların tabiriyle ağır metaller; sertlikleri, yüksek yoğunlukları, iyi ısı iletkenlikleri ve yüksek erime-kaynama sıcaklıklarıyla tanınırlar. Özellikle sertlikleri nedeniyle saf halde ya da alaşım halinde yapı malzemesi olarak kullanılırlar.
Halojenler, periyodik tablonun 7A grubunda bulunan, tepkimeye eğilimli ametallerdir. Bu gruptaki elementlerin hepsinin elektronegatifliği yüksektir. Elektron alma eğilimi en yüksek olan elementlerdir. Doğada elementel olarak değil, mineraller halinde bulunurlar. Element halinde 2 atomlu moleküllerden oluşurlar. Oda koşullarında flor ve klor gaz, brom sıvı, iyotsa katı haldedir. Erime ve kaynama noktaları grupta aşağıdan yukarıya doğru azalır. Zehirli ve tehlikeli elementler olarak bilinirler. Halojenler metallerle reaksiyona girerek iyonik tuzları oluştururlar.
Ametal, metal özelliği göstermeyen elementlerdir. Isıyı ve elektrik akımını iletmek gibi metallere özgü özellikleri göstermezler. Ayrıca kendi aralarındaki ortak özellikleri yok denecek kadar azdır. Genellikle karbon, azot, fosfor, oksijen, kükürt, selenyum, flor, klor, brom, iyot ve soy gaz elementlerine ametal denir.
Celsius ölçeği, 1742'de İsveçli astronom Anders Celsius'un ismiyle adlandırılmış bir sıcaklık ölçme birimidir.

Metal, yüksek elektrik ve ısı iletkenliği, kendine özgü parlaklığı olan, şekillendirmeye yatkın, katyon oluşturma eğilimi yüksek, oksijenle birleşerek çoğunlukla bazik oksitler veren elementler.

Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.

Asfalt, dayanımlı akmaz halden katı hale kadar değişkenlik gösteren siyah, kahverengi ve gri tonlara sahip organik bir maddedir.
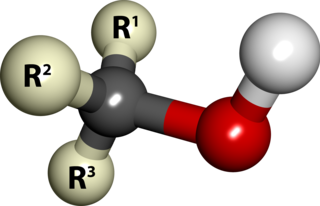
Alkol, karbon atomuna doğrudan bir -OH (hidroksil) grubunun bağlı olduğu organik bileşiklere verilen genel ad. Genel formülü CnH2n+1OH olan mono alkoller, alkollerin önemli bir sınıfıdır. Bunlardan etanol (C2H5OH), alkollü içeceklerde bulunan türüdür. Genellikle alkol kelimesi ile etanol kastedilir ki yeni fermente olmuş birada etanol oranı %3-5 arasında iken şarapta %12-15 arasındadır.

Erime noktası, kristal ve saf olan bir maddenin katı halden sıvı hale geçtiği belirli bir sıcaklıktır. Bu sıcaklığa o maddenin erime noktası denir. Bütün kristal yapıya sahip saf maddelerin erime noktasında, yani katı halden sıvı hale geçene kadar, sıcaklığı sabit kalır. Ancak tamamen sıvı hale geçtikten sonra sıcaklığı yükselir. Saf kristal cisimlerin erime noktası ile donma noktası arasında sıcaklık farkı yoktur. Mesela saf su, 0 °C de donar. Fakat saf olmayan maddelerin, yani karışımların donma ve erime noktaları farklıdır.

Kaynama noktası, sıvının buhar basıncının dış basınca eşit olduğu andaki sıcaklığıdır. Buhar basıncı yüksek olan sıvılar uçucudur ve kaynama noktaları düşüktür. Vakum işlemiyle buhar basıncı arttırılarak, kaynama noktası yüksek olan sıvılar oda sıcaklığında kaynatılabilir.
- Kaynama noktasına göre elementler
- Kaynama noktasına göre bazı çözücüler

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.

Antifriz veya dondurmaz, 0 derece ve altında radyatör suyuna katılarak suyun donmasını önleyen kimyasal maddedir. Antifriz daha çok otomobil motorlarında kullanılır. Bir dialkol türü olan etilen glikol (etandiol) ve propilen glikol (propandiol) iyi birer antifrizdir. Yaygın antifrizler, sıvının kaynama noktasını arttırır ve daha yüksek soğutma suyu sıcaklığına izin verir.

Damıtma ya da destilasyon, iki veya daha fazla bileşen içeren bir karışımın ısıtılıp, buhar ve sıvı faz oluşturmak suretiyle daha uçucu bileşence zengin karışımların elde edilmesini sağlayan ayırma işlemidir. Ayırma işlemi sırasında, buhar faz daha uçucu olan A bileşeni tarafından zenginleşirken, sıvı faz ise kaynama sıcaklığı daha yüksek olan B bileşenince zenginleşir. Fakat yüzde 100 A içeren bir buhar faz elde edilemez.

Düdüklü tencere, yemekleri hızlı pişirmek için buhar ve yüksek basınç yararlanma prensibi ile çalışan tencere. Basınçla suyun kaynama derecesi arasındaki ilişkiden hareketle ortaya çıkmıştır. Düdüklü tencere yemekleri yüksek sıcaklıkta ve tamamen kapalı hâlde pişirdiğinden, yemeklerin pişme süresini en aza indiren, subap ile belirli bir kaynama noktasına ayarlanmış tenceredir. Düdüklü tencerelerde patlama tehlikesine karşı, basınca, dolayısıyla pişme derecesine göre ayarlanabilen bu subap, basınç artınca düdük hava kaçırarak tencerenin patlamasına engel olur. Düdüklü tencere ismini de bu nedenle almıştır.

Hidrojen sülfür, renksiz, çürük yumurta kokusunda zehirleyici bir gazdır. 1796'da C. Louis Berthallet tarafından bileşiği meydana getiren elementler tâyin edildi. Formülü H2S şeklindedir.

Kimyasal madde, kimyevî madde veya kısaca kimyasal, sabit bir kimyasal bileşimi ve karakteristik özelliklere sahip bir madde türüdür. Bu kimyasal bağlar bozulmadan, fiziksel ayırma yöntemleri ile bileşenlerine ayrılmaz. Bu kimyasallar katı, sıvı veya gaz hâlinde olurlar.

Siklobütan (İngilizce: Cyclobutane); molekül formülü (CH2)4 olan, organik bir bileşiktir. Siklobütan bir sikloalkan bileşiğidir. Bir tane halkaya sahiptir. Siklobütan renksizdir, sıvılaştırılmış biçimde ticari olarak temin edilebilir. Siklobütanın tek başına ciddi bir ticari veya biyolojik bir değeri yoktur, ancak siklobütanın karmaşık türevleri hem ticari olarak hem de biyolojik olarak büyük önem ihtiva edebilir. Biyoteknolojide karmaşık türevleri çok önemli bir yere sahiptir. Siklobütanın erime noktası −91 °C, kaynama noktası 12.5 °C olup, yoğunluğu 0.720 g/cm³'tür.
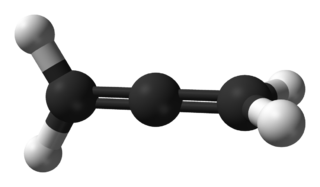
Propadien H2C=C=CH2 formülüne sahip organik bileşik. İki komşu C=C çift bağına sahip en basit bileşik ve allendir. MAPP gazının bir bileşeni olarak kaynak için yakıt olarak kullanılır.
Nonen bir bir alkendir ve C9H18 moleküler formülüne sahiptir. C = C çift bağının konumuna ve molekülün diğer bölümlerinin dallanmasına bağlı olarak birçok yapısal izomeri mümkündür. Endüstriyel olarak, en önemli nonenler propen trimerleridir: Tripropilen. Dallı nonenlerin bu karışımı, aynı zamanda tartışmalı kirleticiler olan deterjanların öncüsü olan nonilfenol üretmek için fenolün alkillenmesinde kullanılır.

Sodyum tiyosülfat Na₂S₂O₃xH₂O formülüne sahip bir inorganik bileşiktir. Tipik olarak beyaz veya renksiz pentahidrat, Na₂S₂O₃·5H₂O olarak mevcuttur. Katı, suda iyi çözünen efloresan kristal bir maddedir.















