
Proteinler, bir veya daha fazla uzun amino asit artık zincirini içeren büyük biyomoleküller ve makromolekül'lerdir. Proteinler organizmalar içinde, hücrelere yapı ve organizmalar sağlayarak ve molekülleri bir konumdan diğerine taşıyarak metabolik reaksiyonları katalizleme, DNA kopyalama, uyaranlara yanıt verme dahil olmak üzere çok çeşitli işlevler gerçekleştirir. Proteinler, genlerinin nükleotit dizisi tarafından dikte edilen ve genellikle faaliyetini belirleyen özel 3D yapıya protein katlanmasıyla sonuçlanan amino asit dizilimlerinde birbirlerinden farklıdır.

Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.

İnsülin, moleküler ağırlığı 5,8 kilodalton (kDa) olan, polipeptit yapılı ve vücuttaki karbonhidrat özüştürmesinin düzenlenmesinde glukagon ile birlikte rol alan bir hormondur. Kan şekerini düşürücü etki yapar. Pankreasın hormonal salgı birimleri olan Langerhans adacıklarından salgılanan insülinin adı da Latincede "ada" anlamına gelen "insula" sözcüğünden türetilmiştir.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.
Kromozom 2, 22 çift insan otozomal kromozomlarından genellikle ikinci en büyük olanıdır. 242 milyondan fazla baz çiftinden oluşan ve toplam DNA'nın %8'ini kapsayan bir kromozomdur. İnsanlarda normalde bir çift olarak bulunur. Kromozom 2, insan ve diğer maymunların ortak kökenli olması lehine çok güçlü kanıtlar sunmaktadır.

Alanin (Ala, A) (HO2CCH(NH2)CH3) aynı zamanda 2-aminopropanoik asit olarak adlandırılır. En sık kullanılan aminoasittir. Proteinlerin yaklaşık olarak %7.8'i alanin yapıtaşlarından oluşmaktadır. D-alanin, bazı bakterilerin hücre duvarlarında ve peptid antibiyotiklerin yapılarında da bulunmaktadır.

Glisin (kısaltılmışı Gly ya da G) formülü NH2CH2COOH olan apolar bir aminoasittir. Glisin kodonları GGU, GGC, GGA, GGG cf. genetik koddur. Yapısal olarak proteinlerde bulunan 20 aminoasit arasında en basit olanıdır. Yan zinciri sadece bir hidrojen atomundan ibarettir. Glisindeki α-karbon atomu da bir hidrojene bağlı olduğu için, glisin optik olarak aktif değildir, diğer bir deyişle optik izomeri bulunmamaktadır.
Lösin DNA tarafından kodlanan 20 aminoasitten biridir. İzolösin ve lösin birbirlerinin izomeridirler. Beslenme açısından lösin dışarıdan alınması elzem (esansiyel) olan bir aminoasittir.
İzolösin proteinlerin yapısında bulunan, DNA tarafından kodlanan 20 temel aminoasitten biridir. Hemen hemen tüm proteinlerde izolösine rastlamak mümkündür.
Histidin doğada yaygın 22 aminoasitten biridir ve proteinlerin yapısında bulunur. L-Histidin ve D-Histidin olmak üzere iki farklı enantiomerik formu vardır. Beslenme açısından, genelde sadece çocuklarda, dışarıdan alınması zaruri gıda maddelerinden biridir.

Lizin proteinlerde bulunan 22 aminoasitten biridir. 4-aminobütil yan zinciri nedeniyle, histidin ve arginin gibi bazik aminoasitler grubuna dahildir.

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.
Fenilalanin beslenme açısından zaruri bir alfa-aminoasittir. Fenilalanin doğada enantiomerik iki formda bulunabilir, D- ve L-fenilalanin. Yan zinciri bir benzil grubundan oluşmaktadır. Bu aminoasitin fenilalanin olarak adlandırılmasının nedeni, kimyasal yapısının, alanındaki hidrojenlerden birisinin fenil grubuyla değiştirilmesiyle olusturulmasıdır. Fenil grubundan ötürü, fenil alanin aromatik bir bileşiktir. Oda sıcaklığında beyaz ve toz şeklinde bir fiziksel bir hâli vardır.
Sistein proteinleri oluşturan 20 aminoasitten biridir. Yan zincirinde içinde kükürt bulunan bir tiyol grubu içerir.

Elastin fibroblast hücreleri tarafından üretilen yapısal bir proteindir. En çok bağ dokusunun hücrelerarası maddesinde yer almaktadır. Proteolizi yine fibroblastlar tarafından sağlanır.
Proteinler her organizmada bulunan önemli bir makromolekül sınıfıdır. Proteinler, 20 farklı tip L-α-amino asitten meydana gelen polimerlerdir. Amino asitler birbiriyle reaksiyona girdikten sonra meydana gelen polimerde bu amino asitlerden arta kalan birimlere amino asit kalıntısı denir. 40 kalıntıdan daha kısa olan zincirler için protein yerine genelde peptit terimi kullanılır. Biyolojik fonksiyonlarını yerine getirebilmek için proteinler uzay içinde belli bir biçim alacak şekilde katlanırlar. Bu katlanmayı yönlendiren güçler, protein atomları arasındaki hidrojen bağı, iyonik etkileşimler, van der Waals kuvvetleri ve hidrofobik istiflenme gibi, kovalent olmayan etkleşimlerdir. Proteinlerin işlevlerini moleküler düzeyde anlayabilmek için genelde onları üç boyutlu yapısının çözülmesi gerekir. Protein yapısını çözmek için X-ışını kristalografisi ve NMR spektroskopisi kullanılır, bunlar yapısal biyolojinin başlıca yöntemleri arasında yer alır.

Peptit ve proteinlerin birincil yapısı, bu moleküllerin yapı birimleri olan amino asitlerin doğrusal sırası veya daha genel olarak, bir proteini oluşturan atomlar arasındaki kovalent bağların spesifikasyonudur.

Biyokimya ve yapısal biyolojide ikincil yapı, protein veya nükleik asit (DNA/RNA) gibi biyopolimerlerin yerel parçalarının genel, üç boyutlu biçimleridir. Buna karşın, atomlarının üç boyutlu uzaydaki konumları üçüncül yapı tanımlamasına girer.
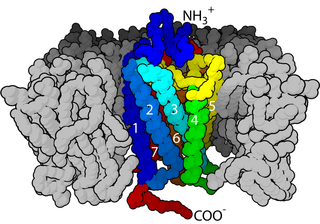
G proteini kenetli reseptörler (GPCR) veya yedi transmembran parçalı yapıda olan reseptörler, geniş bir almaç ailesidir. Hücre dışı bileşikleri algılayarak hücre içi sinyal iletimi (transdüksiyon) yollarını etkinleştirirler. Hücre içinde G proteinlerine bağlanırlar. Hücre zarından kıvrılarak yedi kez geçtiklerinden "yedi transmembran parçalı" (7TM) adlandırmasına da sahiptirler.
Biyosentez, substratların canlı organizmalarda daha karmaşık ürünlere dönüştürüldüğü çok aşamalı, enzim katalizli bir süreçtir. Biyosentezde basit bileşikler modifiye edilir, diğer bileşiklere dönüştürülür veya makromoleküller oluşturmak üzere birleştirilir. Bu süreç genellikle metabolik yollardan oluşur. Bu biyosentetik yollardan bazıları tek bir hücresel organel içinde yer alırken diğerleri birden fazla hücresel organel içinde yer alan enzimleri içerir. Bu biyosentetik yolların örnekleri arasında çift katlı lipit katmanının bileşenlerinin ve nükleotidlerin üretimi yer alır. Biyosentez genellikle anabolizma ile eş anlamlıdır ve bazı durumlarda birbirinin yerine kullanılır.











