Potasyum sülfür
 | |
 | |
| Adlandırmalar | |
|---|---|
Potasyum sülfür | |
Diğer adlar Dipotasyum monosülfür, Dipotasyum sülfür, Potasyum monosülfür, Potasyum sülfür | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.013.816 |
| EC Numarası |
|
PubChem CID | |
| RTECS numarası |
|
| UNII | |
| UN numarası | 1847 1382 |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Molekül formülü | K2S |
| Molekül kütlesi | 110,262 g/mol |
| Görünüm | saf: renksiz saf olmayan: sarı-kahverengi |
| Koku | H2S |
| Yoğunluk | 1,74 gr/cm3 |
| Erime noktası | 840 °C (1.540 °F; 1.110 K) |
| Kaynama noktası | 912 °C (1.674 °F; 1.185 K) (bozunur) |
| Çözünürlük (su içinde) | KHS ve KOH'e dönüşür |
| Çözünürlük | etanol, gliserinde çözünür eterde çözünmez |
| −60,0·10−6 cm3/mol | |
| Yapı | |
| antiFlorür | |
| Termokimya | |
Standart molar entropi (S⦵298) | 105,00 J·mol−1·K−1[1] |
Standart formasyon entalpisi (ΔfH⦵298) | -406,2 kJ·mol−1[2] |
Gibbs serbest enerjisi (ΔfG⦵) | -392,4 kJ·mol[2] |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Cilt yanıklarına neden olur. Çevre için tehlikeli (N) |
| GHS etiketleme sistemi: | |
| Piktogramlar |   |
| İşaret sözcüğü | Tehlike |
| R-ibareleri | R17, R23, R25, R31, R34, R50 |
| G-ibareleri | S24, S26 |
| Tehlike ifadeleri | H314, H400 |
| Önlem ifadeleri | P260, P264, P273, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P391, P405, P501 |
| Benzeyen bileşikler | |
Diğer katyonlar | Sodyum sülfür Demir(II) sülfür |
Benzeyen bileşikler | Potasyum hidrosülfür Potasyum sülfit Potasyum sülfat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.
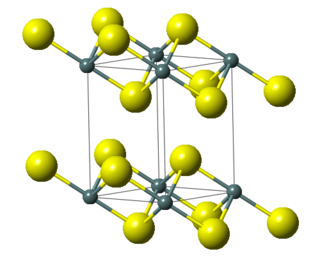
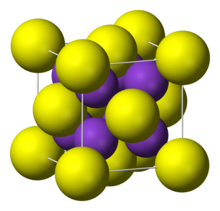
Yapısı
"Antiflorür yapı" ya sahiptir. Bu kristal yapısında küçük K+ iyonları florür’deki tetrahedral (F−) boşluklarını ve daha büyük S2− merkezleri ise sekiz koordinat boşluğunu doldurur. Li2S, Na2S, and Rb2S benzer şekilde kristalleşir.[3]
Elde edilmesi ve reaksiyonları
K2SO4’ün karbonla (kok kömürü) ısıtılmasıyla üretilebilir:
- K2SO4 + 4 C → K2S + 4 CO
Laboratuvarda saf K2S susuz amonyak içerisindeki potasyum ve kükürtün reaksiyonu ile hazırlanabilir.[4]
Potasyum sülfür oldukça baziktir. Bundan dolayı K2S aşağıdaki denkleme göre tamamen ve geri dönüşümsüz olarak hidrolize olur:
- K2S + H2O → KOH + KHS
HS− ve OH− karışımı bir S2− kaynağı olarak davrandığından bu reaksiyon pek çok amaç için önemsizdir. Diğer alkali metal sülfürler de benzer şekilde davranırlar.[3]
Havai fişeklerde kullanımı
Potasyum sülfürler karabarut yandığında oluşur ve senko hanabi ve bazı parıltı formülasyonları gibi birçok piroteknik efektler için önemli ara maddelerdir.[5]
Ayrıca bakınız
- Kükürt karaciğeri
Yararlanılan kaynaklar
- ^ CRC Handbook of Chemistry and Physics (95. bas.). CRC Press. 2014. ss. 5-15. ISBN 1482208679.
- ^ a b Johnson, G.K.; Steele, W.V. (1981). "The standard enthalpy of formation of potassium sulfide (K2S) by fluorine bomb calorimetry". The Journal of Chemical Thermodynamics (İngilizce). 13 (10): 985-990. doi:10.1016/0021-9614(81)90075-6.
- ^ a b Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. 0-12-352651-5.
- ^ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 360.
- ^ Shimizu, Takeo. "Fireworks: the Art, Science, and Technique." Pyrotechnica Publications: Austin, 1981. 0-929388-05-4.