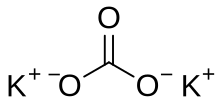
Potasyum karbonat
 | |
 | |
 | |
| Adlandırmalar | |
|---|---|
Potasyum karbonat | |
Diğer adlar Potasa, potas, dipotasyum karbonat, inci külü, tartar tuzu | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.665 |
| E numaraları | E501(i) (asitliği düzenleyiciler, ...) |
PubChem CID | |
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
| Molekül formülü | K2CO3 |
| Molekül kütlesi | 138.205 g/mol |
| Görünüm | Beyaz, higroskopik katı |
| Yoğunluk | 2.43 g/cm3 |
| Erime noktası | 891°C |
| Kaynama noktası | Bozunur |
| Çözünürlük (su içinde) | 112 g/100 mL (20°C) 156 g/100 mL (100°C) |
| Çözünürlük | 3.11 g/100 mL (25°C) metanol, alkol, aseton’da çözünmez |
| −59.0•10−6 cm3/mol | |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar |  |
| İşaret sözcüğü | Uyarı |
| Tehlike ifadeleri | H302, H315, H319, H335 |
| Önlem ifadeleri | P261, P305+P351+P338 |
| NFPA 704 (yangın karosu) | |
| Parlama noktası | Yanmaz |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz) | 1870 mg/kg (oral, sıçan)[1] |
| Güvenlik bilgi formu (SDS) | ICSC 1588 |
| Benzeyen bileşikler | |
Diğer anyonlar | Potasyum bikarbonat |
Diğer katyonlar | Lityum karbonat Sodyum karbonat Rubidyum karbonat Sezyum karbonat |
Benzeyen bileşikler | Amonyum karbonat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Potasyum karbonat, K2CO3 formülüne sahip inorganik bileşiktir. Suda çözünen beyaz bir tuzdur. Nem çekerek sıvılaşan ve genellikle nemli veya ıslak bir katı olarak görülür. Potasyum karbonat esas olarak sabun ve cam üretiminde kullanılır.[2]
Tarihçe
Potasyum karbonat, potasın birincil bileşeni ve daha rafine inci külü veya tartar tuzlarıdır. Tarihsel olarak, inci külü safsızlıkları gidermek için bir fırında potas pişirilerek oluşturuldu. Geriye kalan ince, beyaz toz inci külü idi. ABD Patent Ofisi tarafından yayımlanan ilk patent, 1790'da potas ve inci külü yapmak için geliştirilmiş bir yöntem nedeniyle Samuel Hopkins'e verildi. Kabartma tozunun geliştirilmesinden önce, 18. yüzyılın sonlarında Kuzey Amerika'da, inci külü kek ve kurabiyeler için kabartma ajanı olarak kullanıldı.[3][4]
Üretimi
Potasyum karbonat ticari olarak, potasyum hidroksitin karbon dioksit ile reaksiyonu yoluyla hazırlanır:[2]
- 2 KOH + CO2 → K2CO3 + H2O
Çözeltiden seskihidrat K2CO3•3⁄2H2O ("potas hidrat") kristalleşir. Bu katı maddenin 200 °C'nin üzerine ısıtılması susuz tuzu verir. Alternatif yöntem olarak, potasyum klorür organik amin eşliğinde karbon dioksit ile potasyum bikarbonat vermek üzere reaksiyona sokulur. Elde edilen potasyum bikarbonat daha sonra, kuru kuruya ısıtılarak kalsine edilir:
- 2 KHCO3 → K2CO3 + H2O + CO2
Kullanım alanları
- Tarihsel olarak, sabun, cam ve seramik üretiminde kullanılır.
- Kalsiyum klorür ve magnezyum sülfat gibi diğer kurutucu maddelerin kullanıldığı yerlerde hafif bir kurutucu madde olarak, uygun olmayabilir. Asidik bileşikler için uygun değildir, ancak az miktarda asidik safsızlığa sahip olan bir organik fazın kurutulması için yararlı olabilir. Damıtma işleminden önce bazı ketonları, alkolleri ve aminleri kurutmak için de kullanılabilir.[5]
- Mutfakta, birçok geleneksel kullanımı vardır. Çin ve Güneydoğu Asya mutfağında tüketilen bir gıda olan çim jölesinin yanı sıra, Çin'in elle yapılmış erişte ve ay keki üretiminin bir bileşenidir. Ayrıca işkembeyi yumuşatmak için kullanılır. Alman zencefilli kek tarifleri amonyum karbonat katılsa bile, genellikle bir pişirme maddesi olarak potasyum karbonat kullanılır. Potasyum karbonatın kullanımı, zararı önlemek için belirli bir miktarla sınırlandırılmalı ve kılavuz olmadan kullanılmamalıdır.
- Doğal kakao çekirdeklerinin pH'ını (yani asitliği azaltarak) dengeleyerek Hollanda usulü çikolata üretmek için kakao tozunun alkalizasyonunda; ayrıca aromayı arttırır. Kakao tozuna potasyum karbonat ekleme işlemi genellikle "Dutching" (ve Hollanda usulü işlenmiş kakao tozu olarak adlandırılan ürünler) olarak adlandırılır, çünkü işlem ilk kez 1828'de Hollandalı Coenraad Johannes van Houten tarafından geliştirilmiştir.
- Kuru üzüm üretiminde kurutma işlemine başlamadan önce, ön işlem olarak üzüm salkımları potasyum karbonat ve yağ asidi etil esterlerinden yapılmış soğuk "bandırma " çözeltisine batırılır. Bu işlem tanelerdeki su kaybını artırır ve esmerleşmeyi azaltırarak daha açık renkli kuru üzüm elde edilmesini sağlar.[6] Bu tarihsel üretim süreci Türkiye ve İran başta olmak üzere Akdeniz ve Küçük Asya ülkelerinde uygulanmaktadır.
- Bal şarabı veya şarap üretiminde tampon madde olarak kullanılır.
- Antika belgelerde, sert suyu yumuşatmak için kullanıldığı bildirilmiştir.[7]
- Fritöz ve diğer B sınıfı ilgili yangınları söndürmede yangın söndürücü olarak kullanılır.
- Yoğunlaştırılmış aerosol yangın söndürmede, potasyum nitratın yan ürünü olmasına rağmen kullanılmaktadır.
- Kaynak eritkenlerinde ve ark kaynak çubuklarında eritken kaplamasında bir bileşen olarak kullanılır.
- Et tavukçuluğu yetiştiricileri gibi çiftlik hayvanlarının potasyum gereksinimlerini karşılamak için bir hayvan yemi bileşeni olarak kullanılır.
- İsveç snus'unda asitlik düzenleyici olarak kullanılır.
Kaynakça
- ^ Chambers, Michael. "ChemIDplus - 584-08-7 - BWHMMNNQKKPAPP-UHFFFAOYSA-L - Potassium carbonate [USP] - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.sis.nlm.nih.gov. 12 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Haziran 2020.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). "Potassium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039.
- ^ See references to "pearl ash" in "American Cookery" by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. ss. 18-22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. "Advanced Practical Organic Chemistry" 1998, Stanley Thomas Publishers Ltd
- ^ "Arşivlenmiş kopya" (PDF). 23 Haziran 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 21 Haziran 2020.
- ^ Child, Lydia M. "The American Frugal Housewife" 1832
Daha fazla bilgi için
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 Haziran 2002). "Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol". Journal of Chemical & Engineering Data. 47 (5): 1175-1176. doi:10.1021/je020012v.
Dış bağlantılar
- Uluslararası Kimyasal Güvenlik Kartı 1588 12 Eylül 2019 tarihinde Wayback Machine sitesinde arşivlendi.