Porfirin
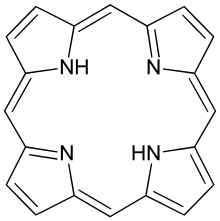
Porfirin, dört metiliden (-CH=) köprüsüyle birbirine bağlı dört pirol halkasından ibaret olan porfin halka sistemi ihtiva eden molekül sistemidir. Bu molekül inorganik yapının organik yani canlı yaşamına nasıl evrildiğinin anlaşılmasını da sağlamıştır. Yani dünyadaki yaşam cansızdan canlıya bu madde ile geçmiştir. Doğada genellikle I ve III numaralı porfirin şekli bulunur. Porfirinlerdeki yan grupların dizilimi simetrik olduğu takdirde Tip I; asimetrik olduğu takdirde Tip III izomerleri oluşur. Tip III izomerleri en fazla bulunan ve önemli olan tiptir.
Doğada bulunan porfirinler, porfin çekirdeğindeki hidrojenlerin yerine çeşitli yan grupların (asetil, propil, metil, vinil) bağlanmasıyla oluşurlar. Porfirinler; sübstitüe (tamamlayıcı) porfinlerdir. Porfin halkasında her pirol halkasının dört karbon atomundan sadece ikisinde hidrojen vardır ve toplam sekiz olan hidrojen atomları yerine organik sübstitüentlerin geçmesiyle porfirin halka sistemi oluşur. Porfin halkasında metil, etil sübstitüentleri hidrojen yerine geçerek etioporfirinler oluşur ve bunlar doğada bulunmaz. Üroporfirinlerdeyse kısa sübstitüent olarak asetik, uzun sübstitüent olaraksa propionik gruplar bulunur. Koproporfirinlerdeyse üroporfirinlerin asetik yan zincirinin dekarboksilasyonu sonucu oluşan kısa sübstitüent metil, uzun sübstitüent ise propionil grubudur. Protoporfirin IX da ise kısa sübstitüent metil, uzun sübstitüentlerden ikisi vinil, ikisi ise propionik grubudur. Koproporfirinlerin iki propionik grubunun dekarboksilasyonu sonucu etil gruplarının teşekkül etmesiyle oluşan porfirine mezoporfirin adı verilir. Mezoporfirin IX da iki etil grubunun hidroksietil grubu şekline dönüşmesiyle hematoporfirin IX oluşur.
Üroporfirin I, III, koproporfirin I, III, protoporfirin IX, mezoporfirin IX ve hematoporfirin IX doğada bulunan başlıca porfirinlerdir. Üroporfirin I, III idrarda, mezoporfirin dışkıda, koproporfirin I, III dışkıda, idrarda, safrada, Eritrositlerde, maya ve bakterilerde bulunan porfirinlerdir.
Üroporfirin, koproporfirin ve protoporfirin birikmesi deri lezyonlarına ve ışığa karşı hassasiyete neden olur. Yapılarında konjuge bağ içerdiklerinden kolaylıkla güneş ışığını absorbe ederler. Serbest radikal oluşumu artarak dokuda hasara neden olur.
Konjuge çifte bağlı bileşikler olduklarından dolayı organik çözücülerde anorganik asitlerdeki çözeltileri kırmızı fluoresan gösterir. Porfirin halka sistemindeki pirollerin azot atomları demir, magnezyum, bakır, çinko gibi bazı metal iyonlarıyla şelat teşkil edebilir. Protoporfirinlerin demirli metal iyonu içeren porfirin sistemleri kanın kırmızı rengini veren hemoglobin, kasın kırmızı rengini veren miyoglobin, sitokrom, sitokrom oksidaz, katalaz ve peroksidazlar demir atomu içeren porfirinlerdir. Klorofilse metal iyonu olarak magnezyum içerir ve yeşil renkli olan bir porfirindir. Protoporfirin IX un Fe2+ iyonu ile meydana getirdiği kelat bileşiğine hem adı verilir. Bu bileşikte Fe2+ pirol halkasındaki azotların iki hidrojeni yerine geçmiş diğer iki azot atomuyla koordine kovalent bağ meydana getirmiştir.
Porfirinler metalsiz ya da metal-porfirin olarak kullanılabilirler. Porfirinlerin fotofiziksel özellikleri uygun bir metal seçerek, pirol birimlerinin sayısı arttırılarak (genişletilmiş porfirin) ya da bazen uzun dallar ekleyerek ayarlanabilir.[1] Çinko ve magnezyum içeren porfirinler daha fazla nitrojen içeren ligand tarafından koordine edilirler ve koordinasyon bağı dinamik olarak değişebilir, Fe (III), Co(III) ve Ru(II)CO'lu diğer metal içeren porfirinlerde ise bağlı nitrojen dinamik sistemler için uygun değildir çünkü bunların değişim hızları çok yavaştır.[2]
Son zamanlarda fonksiyonelleştirilmiş supramoleküler çinko-porfirin sistemleri, ışık toplayan antenlerde ve foto-akım üretiminde fotosentezi taklit etmek için, karbon malzemelerin spesifik çıkarılmasında ve moleküler anahtarlar olarak kullanılmaktadır. Aşağıda çinko-porfirinlerin bazı uygulamaları verilmiştir.
UYGULAMALAR
Işık Toplayan Antenler
Işık toplayan antende üç adet çinko(II)-porfirin dimeri serbest temelli porfirine ve zar duvarlarına bağlanmıştır. ‘unilamellar’ keseye bağlı olan porfirin dimerin seçici eksitasyonu ile çinko-porfirinden serbest temelli porfirine enerji transferi gösterir. Çinko-porfirinin benzer özellikleri elektron transferini de mümkün kılar.
Porfirin Cımbızlar
Çinko-porfirin cımbızları kiralite algılama için örnek olarak verilebilir. Bu molekülde kiral diamin, amino asit ve amino alkol gibi moleküllere iki uçtan bağlanabilen iki adet çinko-porfirin birbirine alkil zinciriyle bağlanmıştır ve o molekülün kesin konfigürasyonunu Cotton etkisine dayanarak belirleyebilir. Kiralite kiral bileşenler eklenmesiyle (ya da akiral bileşenlerin modifiye edilmesiyle) ya da iki akiral porfirinin kiral bir şekilde diğer kiral moleküllerle birleştirilmesiyle porfirinlere sağlanabilir.[3]
Moleküler Ayrıştırma
Çinko-porfirinler fullerenler gibi π-konjuge moleküllerin ayrıştırılmasında da kullanılmaktadır. Mesela bazı ikili porfirinler C60 ve C70 ile kıyaslandığında daha fazla karbonlu fullerenlere karşı 10 ila 16 kat daha fazla ilgiye (afinite) sahiptir ve onların ayrıştırılması için kullanılabilir.[2]
Moleküler Anahtarlar
Çinko-porfirinlerin bir önemli özelliği de çoklu porfirin sistemleriyle birleştiklerinde moleküler anahtar işlevi görmeleridir. Çinko-porfirinlerin bazı ligandlar ile supramoleküler etkileşimi, elektronik yapıda değişimler yaratabilecek şekilsel değişiklikler meydana getirebilir. Bunun bir sonucu olarak makromolekülün floresans tayfı ve emisyon şiddeti değişir. Bu işlem yarışan ligandlar yardımıyla tamamen tersinirdir.[4]
Dallı (dendrimerik) porfirinler
Bazen uzun dallara ayrılmış birimlerin porfirinlere eklenmesi, dallı (dendrimerik) yapılar oluşturur. Bu moleküller genelde küresel yapılar oluşturur, özellikle düzensiz olarak eklendiklerinde moleküler tanıma yapabilmektedirler. Bu nedenle onlardan nano-ebatlarda reseptör olarak faydalanılabilinir, daha fazlası metaloenzimleri taklit ederek, kimyasal reaksiyonların gerçekleşebileceği özel dizayn edilmiş nano-bölgeler sağlayabilirler. Çinko temelli porfirinler fotokimyasal özellikleri sayesinde bu işlemler için uygundurlar ve aynı zamanda birçok organik molekülle koordinasyon kompleksi oluşturma kabiliyetleri vardır.[5]
Kaynakça
- ^ Shinoda S. (2007) Nanoscale substrate recognition by porphyrin dendrimers with patched structures. J Incl Phenom Macrocycl Chem 59:1-9
- ^ a b Satake A, Kobuke Y. (2005) Dynamic supramolecular porphyrin systems. Tetrahedron 61:13-41
- ^ Hayashi T, Aya T, Nonoguchi M, Mizutani T, Hisaeda Y, Kitagawa S, Ogoshi H. Chiral recognition and chiral sensing using zinc porphyrin dimers. Tetrahedron 58:2803-11
- ^ Zinic M. (2004) Porphyrin Derivatives, Functional. Encyclopedia of Supramolecular Chemistry Taylor&Francis, FL.
- ^ S. Shinoda, “Nanoscale substrate recognition by porphyrin dendrimers with patched structures,” Journal of Inclusion Phenomena and Macrocyclic Chemistry 59, No. 1 (2007): 1-9