
Arsin AsH3 formüllü inorganik bileşik. Bu yanıcı ve fazlaca zehirli gaz, arsenik elementinin en basit bileşiklerinden biridir.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

Kalsiyum klorür (CaCl2), kalsiyum ve klorun tuz formudur. Bu bileşik tipik iyonik halojenür gibi hareket eder ve oda sıcaklığında katıdır. Yaygın uygulamaları tuzlu su olarak soğutma tesisleri, yollarda buz ve toz kontrolü ve kurutulması şeklindedir. Higroskopik doğası gereği susuz kalsiyum klorür hava-sızdırmaz kaplar içinde tutulmalıdır.

Lityum bromür (LiBr) lityum ve bromun bir bileşiği.Ekstrem higroskopik karakteri LiBr'yi son iklimlendirme sistemlerinde nemçekici olarak kullanılması açısından kullanışlı hale getirmiştir.

Azot pentaoksit N2O5 formüllü kimyasal bileşik. Diazot pentaoksit olarak da bilinir. Sadece azot ve oksijen içeren azot oksit ailesinin ikili bileşiklerinden biridir. Kararsız ve potansiyel oksitleyicidir.
Periyodik asit iyotun en yüksek oksoasitidir. Bütün periodatlar gibi iki form halinde var olur: H5IO6 formülü ile gösterilen ortoperiyodik asit ve HIO4 formüllü ile gösterilen metaperiyodik asit.

Perksenatlar, ksenonun oluşturduğu XeO4-6 anyonunu içeren tuzlardır. Bu tuzlar, Raman saçılmasıyla belirlenen sekiz yüzlü moleküler geometri yapısına sahip olup oksijen-ksenon-oksijen bağ açıları 87° ile 93° arasında değişkenlik gösterir. Ksenon ile oksijen arasındaki bağın uzunluğu ise X ışını kristalografisi tarafından 1,875 Å olarak belirlenir.

Hipoiyodöz asit, HOI kimyasal formülü ile gösterilen inorganik bir bileşiktir. Sulu bir iyot çözeltisinin cıva veya gümüş tuzları ile işlenmesi durumunda oluşur. Disproporsiyonlaşma ile hızla ayrışır:
- 5 HOI → HIO3 + 2I2 + 2H2O

Çinko siyanür, Zn(CN)2 formüllü ile gösterilen bir inorganik bileşiktir. Esas olarak çinko kaplamada kullanılan beyaz renkli bir katıdır, ancak organik bileşiklerin sentezi için daha özel uygulamalara da sahiptir.

Kimyada, üçgen düzlemsel, merkezde bir atom ve birer üçgenin köşelerinde üç atom olan ve hepsi bir düzlemde çevresel atomlar olarak bulunduğu bir moleküler geometri modelidir. İdeal bir üçgen düzlemsel türde, üç ligand aynıdır ve bütün bağ açıları 120°'dir. Bu türler D3h nokta grubuna aittir. Üç ligandın aynı olmaadığı H2CO gibi moleküller, bu ideal geometri sapma gösterir. Üçgen düzlemsel bir şekle sahip moleküller arasında boron triflorür (BF3), formaldehit (H2CO), fosgen (COCl2) ve kükürt trioksit (SO3) bulunmaktadır. Üçgen düzlem geometrisi olan bazı iyonlar arasında nitrat (NO3-), karbonat (CO3−2) ve guanidinyum (C(NH2)3+)) bulunmaktadır. Organik kimyada, üçgen düzlemsel olarak karbon merkezlerine üç bağlı atomun bulunduğu moleküller çoğunlukla sp2 hibridizasyona sahip olarak tarif edilmiştir.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:
Elektron aktarımı ya da elektron transferi, bir elektronun bir atom ya da molekülden, başka bir kimyasal varlığa geçmesi olayıdır. Redoks reaksiyonunun mekanik bir tanımlaması olup, reaksiyona giren ve reaksiyondan çıkan maddelerin yükseltgenme seviyeleri değişir. Elektron aktarımı bir iyonik bağlanmadır.

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
Hiponitröz asit, H2N2O2 veya HON=NOH formülüne sahip kimyasal bir bileşiktir. Bir nitramid, H2N−NO2 izomeridir.
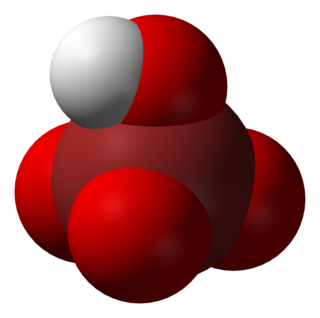
Perbromik asit, HBrO4 formülüne sahip bir inorganik bileşiktir. Bir brom oksoasitidir. Perbromik asit kararsızdır ve periyodik asit hazırlandıkça klorun perklorik asitten yer değiştirmesi ile oluşturulamaz; sadece perbromat iyonunun protonlanması ile yapılabilir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.
İnterhalojen, iki ya da daha fazla farklı halojen atomu içeren ve halojenler dışında herhangi bir başka element atomu içermeyen bileşiktir. Üç ya da daha fazla halojen içeren interhalojenin varlığına kein olarak rastlanmasa da, bazı kaynaklarda IFCl2 veya IF2Cl bileşiklerinin varlığından söz edilmektedir. Teorik çalışmalar ise BrClFn serisindeki bazı bileşiklerin neredeyse kararlı olduğunu gösterir.
Kurşun beyazı, kurşun elementinin rengidir. Zararlı bir renktir, Çünkü içindeki kurşun vücuda girince hastalıklara sebep olur. Diğer zararlı renkler Scheele yeşili ve uranyum oksit turuncusudur.
Su kompleksi, tek ligandın su olduğu metal iyonları içeren bir komplekstir. Bu kompleksler; metal nitratlar, sülfatlar ve perkloratlar gibi çeşitli metal tuzlarının su çözeltilerindeki baskın türdür.













