
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Propanol, üç karbonlu doymuş alifatik alkol. Normal propanolün (n-propanol) formülü CH3CH2CH2OH olup buna 1-propanol de denir. Renksiz, akışkan, keskin ve hoş olmayan bir kokuya sahiptir. Su ve organik çözücülerde çözünür. n-Propanol, karbon monoksit ve hidrojenden metanol elde ederken, propan ve bütanın oksidasyonu esnasında ve Fischer-Tropsch reaksiyonunda yan ürün olarak elde edilir. Etilen, karbon monoksit ve hidrojenden okso sentezi ile imalatı cezbedici bir yoldur. n-propanol en çok çözücü ve kimyasal ara madde olarak kullanılır.

Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Lipit, tüm canlıların yapısında bulunan temel organik bileşiklerden biridir. Lipitler, doymuş ve doymamış yağlar olarak ayrılır. Doymamış yağlar, oda sıcaklığında sıvı hâlde bulunan lipitler; doymuş yağlar ise oda sıcaklığında katı hâlde bulunan lipitlerdir. Biyolojik önemi olan lipitler için yağ asitleri, nötr lipitler (trigliserit), fosfolipitler ve steroitler örnek gösterilebilir. Lipitler, insan ve hayvanların temel besinleri arasında yer alır.
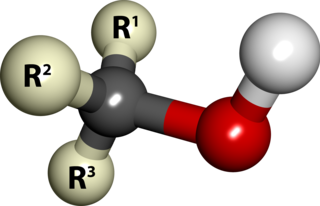
Alkol, karbon atomuna doğrudan bir -OH (hidroksil) grubunun bağlı olduğu organik bileşiklere verilen genel ad. Genel formülü CnH2n+1OH olan mono alkoller, alkollerin önemli bir sınıfıdır. Bunlardan etanol (C2H5OH), alkollü içeceklerde bulunan türüdür. Genellikle alkol kelimesi ile etanol kastedilir ki yeni fermente olmuş birada etanol oranı %3-5 arasında iken şarapta %12-15 arasındadır.

Gliserin, diğer adı gliserol olan, sıvı hâlde bulunan polar organik bir trihidroksi alkoldür. Hafifçe tatlı, zehirli olmayan bir sıvıdır. Su ve etanol ile karışır; asetonda çözünür.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.
Asidimetri, bir çözeltinin baz içeriğinin, standart asit çözeltisi ile titre edilerek saptanması işlemi.
Kimyada bir dehidrasyon veya kondenzasyon tepkimesi, tepkiyen moleküllerden su kaybının meydana geldiği bir kimyasal tepkimedir. Dehidrasyon tepkimeleri eliminasyon tepkimelerinin bir alt grubudur. Hidroksil grubu (-OH) kolay ayrılan bir grup olmadığı için bir Bronsted asit katalizörü hidroksil grubunu protonlaştırıp daha kolay ayrılan bir -OH2+ grubu oluşturur. Selülozlar Bu gruba dahil değildirler.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
Hidrojen peroksit (H2O2), saf haldeyken oldukça açık mavi renkte; sulandırıldığında ise renksiz hale gelen bir bileşiktir. Viskozitesi sudan daha yüksek olan ve zayıf asidik özellik gösteren bileşik, aynı zamanda güçlü bir oksitleyicidir. Özellikle tıp alanında %3'lük sulu çözeltisi ve kâğıt sanayiinde kâğıtlara beyaz renk vermek için kullanılmaktadır. Bileşik ayrıca dezenfektasyon, oksitleme, antiseptik üretimi ve roket yakıtı üretiminde de tercih edilir.

Sodyum bisülfat, diğer bir adı sodyum hidrojen sülfat (NaHSO4) olan bu kimyasal madde asit tuz karakterlidir. Kuru halde iken güvenli bir şekilde nakledilebilir ve depolanabilir. Susuz formu higroskopiktir. Sodyum bisülfat suda hidroliz olarak asidik çözelti verir. 1 Molarlık çözeltisinin pH değeri 1 den küçüktür. Sodyum bisülfat yavaşça ısıtılırsa suyunu kaybederek sodyum pirosülfata dönüşür.
- 2NaHSO4 → Na2S2O7 + H2O

Yükseltgen madde bir yükseltgenme-indirgenme (redoks) reaksiyonunda başka bir türden bir elektron alan element ya da bileşiktir. Yükseltgen maddelerin elektron kazandıklarından dolayı indirgendikleri söylenebilir.

Peroksitler, R−O−O−R yapısına sahip bir grup bileşiktir. Bir peroksit içindeki O−O fonksiyonel grubu, peroksit grubu veya perokso grubu olarak adlandırılır. Oksit iyonlarının aksine, peroksit iyonundaki oksijen atomları -1 yükseltgenme seviyesine sahiptir.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.
Kromik asit terimi genellikle, katı krom trioksit de dahil olmak üzere çeşitli bileşikler içerebilen bir dikromata konsantre sülfürik asit eklenerek yapılan bir karışım için kullanılır. Bu tür kromik asit, cam için bir temizleme karışımı olarak kullanılabilir. Kromik asit ayrıca trioksitin anhidrit olduğu H2CrO4 moleküler türlerine de atıfta bulunabilir. Kromik asit, +6 (veya VI) oksidasyon durumunda krom içerir. Güçlü ve aşındırıcı bir oksitleyici ajandır.

Fenton reaktifi kirleticileri veya atık suları oksitlemede kullanılan, katalizör olarak demir içeren bir demir bileşiği (genellikle demir (II) sülfat, FeSO4) ile hidrojen peroksitin (H2O2) bir çözeltisidir. Fenton reaktifi, trikloroetilen (TCE) ve tetrakloroetilen (perkloroetilen, PCE) gibi organik bileşikleri yok etmek için kullanılabilir. 1890'larda Henry John Horstman Fenton tarafından analitik bir reaktif olarak geliştirilmiştir.














