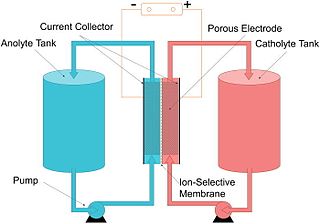
Pil


Pil, kimyasal enerjinin depolanabilmesi ve elektriksel bir forma dönüştürülebilmesi için kullanılan bir aygıttır. Piller, bir veya daha fazla elektrokimyasal hücre, yakıt hücreleri veya akış hücreleri gibi, elektrokimyasal aygıtlardan oluşur.
Bilinen en eski insan yapımı pil MÖ 250 ve MS 640 yılları arasında yapıldığı tahmin edilen Bağdat pilidir. Pillerin gelişimi, 1800 yılında İtalyan fizikçi Alessandro Volta tarafından geliştirilen voltaik pil ile başlamıştır. Dünya çapında pil endüstrisi (2005) 48 milyar ABD doları ciroya sahiptir.
Tarihi
Günümüzde kullanılan en önemli araçlardan biri olan pil, 1800 yılında tesadüf sonucu bulunmuştur. Elektriğe ilişkin bilgiler, MÖ 6. yüzyıl yıllarına kadar gitmekle [] birlikte bilimsel olarak ilk defa 17. yüzyılda ele alınmıştır. Ancak 19. yüzyıla kadar bilinen elektrik türü, bir kumaşa sürterek elde edilen ya da yıldırım elektriği olarak bilinen statik elektriktir. 19. yüzyılda buna elektrik akımı eklenmiş ve sürekli elektrik akımını mümkün kılan pil icat edilmiştir. Elektriğin bu dalındaki çalışmaları başlatan kişi, ünlü kurbağa deneyi ile tanınan Luigi Galvani (1737-1798)’dir.
1780 yılında yaptığı deneylerin sonuçlarını 1791’de açıklayan Galvani, "hayvansal elektrik" teorisini ortaya attı. Bu teorisini, rastlantı sonucu ölü bir kurbağanın bacağındaki sinirlerin neşter ile kesildiğinde kasıldığını gözleyerek oluşturmuştu. Buna göre, canlıları oluşturan hücreler elektrik içermekteydi.
1793'te Galvani'nin deneylerine devam eden Alessandro Volta (1745-1827) kurbağa bacağı kasılmalarının farklı iki metalden kaynaklandığını bulur. Bacağın uyarılması, birbirine benzemeyen iki farklı metalden ve hücrelerin sıvı içermesinden kaynaklanıyordu. O hâlde elektrik elde edebilmek için iki farklı metale ve sıvıya ihtiyaç olmalıydı. Bundan yararlanarak bakır ve çinko madenleri alarak aralarına tuzlu suya batırılmış süngerler yerleştiren Volta, elektrik akımını elde etmeyi başardı. Böylece Volta Pili adı verilen pili buldu (1800).
Böylece Volta, Galvani'nin biyolojik deneylerinin sonucu olan Hayvansal Elektrik Teorisi’ni ortadan kaldırdı. Galvani’nin deneyleri bilim tarihinin en ilginç olaylarından birisidir. Galvani ve Volta arkadaştılar ve Galvani asla Volta’ya kuramını ortadan kaldırdığı için kin duymadı. Volta da Galvani’nin deneylerinin güzel ve şaşırtıcı deneyler olduğunu yazmaktaydı. Çalışmalarından ötürü Napolyon onu ödüllendirdi ve Avusturya İmparatoru, onu Padua Üniversitesinde Felsefe Fakültesi Başkanlığına getirdi. Ölümünden 54 yıl sonra 1881’de Volt adı, elektrik potansiyel farkı (gerilim) birimi olarak onun anısına ithafen kullanılmaya başlandı.
Çeşitleri
Genel olarak piller, tek kullanımlık (en:Primary cell) ve yeniden doldurulabilen piller olarak ikiye ayrılır.
- Kullanıldıktan sonra işlevini yitiren (şarj edilmeyen) piller: Bu tür pillerde elektrik üretiminin pil içinde sebep olduğu kimyasal reaksiyonun ters yönde elektrik verildiğinde ters yönde kimyasal reaksiyon olarak gerçekleştirilmeye müsait olmadığı pillerdir.
- Çinko-karbon pil - Düşük maliyetli - az enerji gerektiren uygulamalar için.
- Çinko-klorür – Çinko–karbon pilden biraz daha uzun ömürlüdür.
- Alkalin pil - Alkaline/manganez "uzun ömürlü" pillerdir, daha fazla güç ihtiyacı gerektiren uygulamalarda da kullanılabilir.
- Gümüş oksit pil – Genelde işitme cihazlarında kullanılır.
- Lityum pil – Genelde dijital kameralarda kullanılır. Saat ve bilgisayar saatlerinde de kullanıldığı görülür. Çok uzun ömürlüdür, fakat pahalıdır.
- Cıva pil – Genelde dijital saatlerde kullanılır.
- Çinko-hava pili – Genel olarak işitme cihazlarında kullanılır.
- Isıl (Termal) pil – Yüksek sıcaklık depolar. Askeri uygulamalarda önem taşır.
- Şarj edilebilen (tekrar kullanılabilen) piller: Bu tür pillerde elektrik üretiminin pil içinde sebep olduğu kimyasal reaksiyonun ters yönde elektrik verildiğinde ters yönde kimyasal reaksiyon olarak gerçekleştirilmeye müsait olanlardan seçildiği pillerdir.
- Kurşun-asit pil – Araçlar, alarm sistemleri ve kesintisiz güç ihtiyacı olan yerlerde kullanılır.
- Lityum-iyon pil – Oldukça yaygın olan türdür. Yüksek şarj yoğunluğu vardır. Dizüstü bilgisayar, cep telefonları, müzik çalarlar ve daha birçok taşınabilir elektronik cihazda kullanılır.
- Lityum-iyon polimer pil – Lityum iyon pilin temel karakteristiklerini taşır, farkı daha az şarj yoğunluğu olmasıdır. Bu pilin kimyası üreticinin ihtiyacına göre kullanım yeri avantajı yaratabilmesidir. (Örneğin; ultra –ince pil)
- Sodyum-sülfür (NaS) pil
- Nikel-demir pil
- Nikel metal hidrür (Ni-MH) pil
- Nikel-kadmiyum pil - Li-Ion ve Ni-MH pil tiplerinin tüm uygulamalarında kullanılabilir. Bu pil, uzun şarj adedine sahiptir (1500 defanın üzerinde). Fakat diğer tiplere göre daha az enerji yoğunluğuna sahiptir. Ni-Cd piller eski teknolojide kullanılmakta olup, hafıza sorunlarına yol açmalarından dolayı yerini modern pillere bırakmaktadır. Ayrıca içerdiği kadmiyum dolayısı ile kullanımı sınırlandırılmaktadır.
- Sodyum-metal klorür pil
- Nikel–çinko pil
- Erimiş tuz pili Bu pilin avantajı elektriği üreten ve depolayan kısımlarının tuzlu sıvının hareket edebilmesiyle birbirinden bağımsız olabilmesidir.
Pillerin bir araya gelerek oluşturdukları pil gruplarına "Batarya" denmektedir. 1960'lardan önceki lambalı radyo alıcılarında yaygın olarak kullanılmakta idi. Günümüzde ise taşınabilir bilgisayarda yaygın olarak bataryalar kullanılır. Cep telefonlarında ise, yeni çıktıklarında 3 hücreli bataryalar kullanılmakta idi. Ancak şu anda neredeyse tüm telefon modellerinde tek hücreli Lityum iyon piller kullanılıyorsa da, alışkanlık sebebi ile bunlar da hatalı olarak "batarya" diye adlandırılmaktadır.
Meyveden pil üretimi
Limondan ya da asit içerikli başka meyvelerden basit piller yapmak mümkündür. Bu tip pillere, kimyasal enerjiyi elektrik enerjisine dönüştürmeleri nedeniyle “voltaik piller” adı veriliyor. Piller, asidik bir çözelti içerisine iki farklı metalin yerleştirilmesi mantığıyla yapılır. Buna göre, limona örneğin çinkoyla kaplanmış bir çivi ve bakır bir madeni para batırıldığında, limon suyu gerekli asit çözeltisini oluşturur ve elektrik üretebilir. Ancak elde edilen elektrik akımı oldukça zayıf olup, LED’de hafif bir ışıma sağlamaya yetecek kadardır.
Tehlikeleri
250 yıllık gelişiminden beri piller en pahalı enerji kaynakları arasında yer almaktadır, ayrıca bünyesinde çok pahalı ürünler hatta bazen cıva, kurşun, nikel gibi riskli kimyasallar bulundurmaktadır. Bu yüzden günümüzde kimyasal madde içeriği olduğu için insan metobolizmasını etkilemekte ölümcül sebeplere neden olmaktadır. Piller yutulduğunda tehlikeli ve ölümcül olabilirler. (Çapları 20 mm'den fazla olan piller yutulduklarında yemek borusuna yapışmasıyla ölümcül olabilmektedir fakat tam aksine sindirim sistemi ile dışarı atılır ve vücuda hasar vermez[1]). Artık çoğu bölgelerde kullanılmış pillerdeki toksit maddelerin geri kazanımı için geri dönüşüm düzenleri kurulmuştur.
Çevreye atılan atık piller çevre kirliliğine sebep olduğu gibi güneş ısısının etkisiyle patlama sonucu içindeki kimyasal maddelerin dışarı çıkması ile insan ve çevre sağlığı için risk taşımaktadır.
Pil ve batarya ile çalışan elektronik aletlerin ve özellikle elektrikli taşıtların enerji kaynakları da alışılmadık yeni tehlikeleri getirir. Piller üretim veya kullanımda zedelenip riskli hale gelebilir, doldururken veya kullanırken aniden yanabilir, enerji yoğunluğu yüzünden bu yanma patlama hızıyla ve söndürülemez şekilde gelişebilir, cepteyken yanma vücutta yanıklara ve elektrik çapmasına sebep olabilir, kapalı mekanda doldurulurken yanan küçük bir pil, mekanı kullanılamaz hale getirebilir, çarpışmış taşıtta kazazedeler için ezilme, sıkışma, kırık, kesik, patlama ve yanma tehlikelerinin yanı sıra elektrik çapması tehlikesi de söz konusu olabilir.
Bataryaların ne denli tehlike oluşturabileceğine bir örnek olarak; Galaxy Note 7'nin satışa sunulmasının ardından donanımsal sorunlardan kaynaklı patlamalar yaşanması sebebiyle, ilk olarak 16 Eylül 2016 tarihinde Samsung tarafından cihazların yenilenme kararı verilmiştir. Yenilenen Note 7'lerde de patlama sorununun devamından dolayı Galaxy Note 7'nin üretimi durdurulmuştur.
Rohs Belgesi
Özellikle pil, batarya üretimi ve ithalatında bazı zararlı maddelerin kullanımının sınırlandırılması amacıyla pil ve batarya atıklarının çevreyle uyumlu olduğunu gösteren belge. Bu belgeye sahip olmadan hiçbir ithalatçı ya da üretici imalat ve ithalat yapamaz. Rohs Belgesi ile batarya ve pillerde aşağıda yazılı maddeler test ile aranır. Bunlar; Kurşun (Pb) Cıva (Hg) Kadmiyum (Cd) Hexavalent krom (VI) (Cr (VI) Certain brominated flame retardants (BFR’s) Polybrominated biphenyls (PBB’s) Polybrominated diphenyl ethers (PBDE’s) Bu testler akredite laboraturlar tarafından yapılır.
Ayrıca bakınız
Kaynakça
- ^ "Düğme vey Para biçimindeki Pillerin Yutulması". Tap. 29 Eylül 2018. 28 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Şubat 2023.
- Power Shift : DFJ on the lookout for more power source investments - Draper Fisher Jurvetson
- Lemon Battery - Hila Road14 Aralık 2017 tarihinde Wayback Machine sitesinde arşivlendi.
Dış bağlantılar
- Atık Pillerinizin Tehlikeli Atık Kapsamında Geri Dönüşümünü Sağlamak İçin...29 Ekim 2018 tarihinde Wayback Machine sitesinde arşivlendi.
- The Lemon Battery - ushistory.org 7 Ekim 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- Li-ion-karbon nanotüp piller 28 Ekim 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- Li-hava pilleri 15 Şubat 2015 tarihinde Wayback Machine sitesinde arşivlendi.
- Al-air batarya 30 Nisan 2013 tarihinde Wayback Machine sitesinde arşivlendi.
- Dual karbon piller 31 Mayıs 2014 tarihinde Wayback Machine sitesinde arşivlendi.
- Yeni nesil Li-ion piller 20 Ekim 2014 tarihinde Wayback Machine sitesinde arşivlendi.