Pikrik asit
 | |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Sistematik IUPAC adı 2,4,6-Trinitrobenzenol | |||
Diğer adlar Pikrik asit[1] Karbazotik asit Fenol trinitrat Pikronitrik asit Trinitrofenol 2,4,6-Trinitro-1-fenol 2-Hidroksi-1,3,5-trinitrobenzen TNP Melinit | |||
| Tanımlayıcılar | |||
CAS numarası | |||
3D model (JSmol) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.001.696 | ||
PubChem CID | |||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA) | |||
| |||
| |||
| Özellikler | |||
| Molekül formülü | C6H3N3O7 | ||
| Molekül kütlesi | 229.10 g·mol−1 | ||
| Görünüm | Renksiz – sarı katı | ||
| Yoğunluk | 1.763 g·cm−3, katı | ||
| Erime noktası | 122.5 °C | ||
| Kaynama noktası | >300 °C Patlar | ||
| Çözünürlük (su içinde) | 12.7 g·L−1 | ||
| Buhar basıncı | 1 mmHg (195 °C)[2] | ||
| Asitlik (pKa) | 0.38 | ||
| -84.34•10−6 cm3/mol | |||
| Patlayıcı verileri | |||
| Patlama hızı | 7,350 m·s−1 ρ 1.70 | ||
| REFaktörü | 1.20 | ||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | patlayıcı | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |   | ||
| İşaret sözcüğü | Tehlike | ||
| R-ibareleri | R1 R4 R11 R23 R24 R25 | ||
| G-ibareleri | S28 S35 S37 S45 | ||
| Tehlike ifadeleri | H201, H301, H311, H331 | ||
| Önlem ifadeleri | P210, P280, P301+P310, P312 | ||
| NFPA 704 (yangın karosu) | |||
| Parlama noktası | 150 °C [2] | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LDLo (yayınlanan en düşük) | 100 mg/kg (kobay, oral) 250 mg/kg (kedi, oral) 120 mg/kg (tavşan, oral)[3] | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | TWA 0.1 mg/m3 [deri] | ||
| REL (tavsiye edilen) | TWA 0.1 mg/m3 ST 0.3 mg/m3 [deri][2] | ||
| IDLH (anında tehlike) | 75 mg/m3[2] | ||
| AB sınıflandırması | Şablon:Hazchem T Şablon:Hazchem E Şablon:Hazchem F+ | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
Pikrik asit (O2N)3C6H2OH formülüne sahip bir organik bileşiktir. IUPAC adı 2,4,6-trinitrofenoldür (TNP). "Pikrik" adı, acı tadı yansıtan "acı" anlamına gelen Yunanca πικρός (pikros) kelimesinden gelir. En asidik fenollerden biridir. Diğer yüksek oranda nitratlanmış organik bileşikler gibi pikrik asit de patlayıcıdır, dolayısıyla birincil kullanımıdır. Aynı zamanda, tıpta (antiseptik, yanık tedavileri) ve boyar maddelerde kullanılmıştır.
Tarihçe
Pikrik asit muhtemelen ilk olarak Johann Rudolf Glauber’in simya yazılarında bahsedilmiştir . İlk olarak, hayvan boynuzu, ipek, indigo ve doğal reçine gibi maddelerin nitrolamasıyla yapılmıştır. İndigodan yapılan sentezi, ilk olarak 1771 yılında Peter Woulfe tarafından gerçekleştirildi.[4] Pikrik asit 1841 yılında Fransız kimyager Jean-Baptiste Dumas tarafından adlandırıldı.[5] Fenolden sentezi ve formülünün doğru belirlenmesi, 1841'de başarıyla gerçekleştirildi.[6] 1799'da Fransız kimyager Jean-Joseph Welter (1763-1852) ipeği nitrik asitle muamele ederek pikrik asit üretti; potasyum pikratın patlayabileceğini buldu.[7] 1830'a kadar kimyagerler pikrik asidi bir patlayıcı olarak kullanmayı düşünmemişlerdi. O zamandan önce kimyagerler, asidin kendisinin değil, yalnızca pikrik asit tuzlarının patlayıcı olduğunu varsaydılar.[8] 1871 yılında, Hermann Sprengel patlatılabileceğini kanıtladı[9] ve çoğu askeri güçler, ana yüksek patlayıcı maddesi olarak pikrik asit kullandı. Pikrik asit ayrıca metallerin, cevherlerin ve minerallerin analitik kimyasında da kullanılır.
Pikrik asit, geleneksel ağır silahlarda ateşleme şokuna dayanmak için yaygın olarak uygun olduğu düşünülen ilk yüksek patlayıcı nitratlı organik bileşikti. Nitrogliserin ve nitroselüloz (pamuk barutu) daha önce mevcuttu, ancak şok duyarlılığı bazen ateşleme sırasında topçu namlusunda patlamaya neden oluyordu. 1885 yılında, Fransız kimyager Eugène Turpin, Hermann Sprengel'in araştırmasına dayanarak, patlatma yüklerinde ve top mermilerinde preslenmiş ve dökme pikrik asit kullanımının patentini aldı. 1887'de Fransız hükümeti, Melinit adı altında pikrik asit ve pamuk barutu karışımını kabul etti. 1888’de, İngiltere, Lydd, Kent'te Lyddit adı altında çok benzer bir karışım üretmeye başladı. Japonya şimoza barutu olarak bilinen "geliştirilmiş" bir formül ortaya çıkardı. 1889'da, benzer bir madde, amonyum krezilat ile trinitrokreozol karışımı veya trinitrokreozolün bir amonyum tuzu, Avusturya-Macaristan İmparatorluğun'da ekrasit adı altında üretilmeye başlandı. 1894'te Rusya, pikrik asitle doldurulmuş top mermileri üretiyordu. Amonyum pikrat (Dunnit veya explosive D olarak bilinir), Amerika Birleşik Devletleri tarafından 1906'dan itibaren kullanıldı. Ancak, bileşik ana fenolden daha hassas metal pikratlar oluşturmak için metal mermi veya tapa muhafazaları ile reaksiyona girerse, pikrik asit ile doldurulmuş mermiler oldukça kararsız hale gelir. Pikrik asidin duyarlılığı Halifax Patlamasında görüldü. Pikrik asit Omdurman Savaşı,[10] II. Boer Savaşı,[11] Rus-Japon Savaşı,[12] ve I. Dünya Savaşı’nda kullanıldı.[13] Almanya 1902'de top mermilerini TNT ile doldurmaya başladı. Toluen fenolden daha kolay bulunabiliyordu ve TNT pikrik asitten çok daha az güçlüdür. Ancak mühimmat üretimi ve depolamasının güvenliği, Dünya Savaşları arasında çoğu askeri amaç için pikrik asidin TNT ile değiştirilmesine neden oldu.[10]
Pikrik asidin öncül maddesi olan fenolün mevcudiyetini kontrol etme çabaları, I. Dünya Savaşı'ndaki önemini vurgulamaktadır. Almanların ABD’den fenol satın aldıkları ve bu durumu Müttefiklerden gizlemek için fenolü asetilsalisilik asite, yani aspirine dönüştürdükleri bildirilmiştir. Bkz. Büyük Fenol Komplosu. O zamanlar, fenol kok kömürü fırınlarının ve gaz aydınlatması için yapılan gaz üretiminin bir yan ürünü olarak kömürden elde ediliyordu. Laclede Gas Şirketi, seferberliği desteklemek için fenol (ve toluen) üretimini artırmasının istendiğini bildirdi.[14] Hem Monsanto[15] hem de Dow Chemical[16] 1915’de sentetik fenol üretimini üstlendi. Dow lider üreticiydi. Dow, pikrik asidi “Fransızlar tarafından kullanılan ana muharebe patlayıcısı olarak tanımlar. Büyük miktarlarda [fenol] de Japonya'ya gitti. Burada pikrik asit haline getirilip Ruslara satıldı.”[17]
Thomas Edison'un pikap kayıtlarını üretmek için fenole ihtiyacı vardı. EdisonSilver Lake, NJ'deki tesisinde kimyagerleri tarafından geliştirilen süreçleri kullanarak fenol üretimini üstlendi.[18] Günde altı ton fenol kapasiteli iki tesis kurdu. Üretim, Avrupa'da düşmanlıkların başlamasından bir ay sonra, Eylül ayının ilk haftasında başladı. Daha önce Almanya'dan gelen malzemeleri değiştirerek Johnstown, PA ve Bessemer, AL'de benzen hammaddesini üretmek için iki fabrika kurdu. Edison ayrıca daha önce, Alman boyar madde tröstü tarafından tedarik edilen anilin boyar maddeleri de üretti. Diğer savaş zamanı ürünleri ksilen, p-fenilendiamin, şellak ve piraks bulunur. Savaş zamanı kıtlığı bu girişimleri karlı hale getirdi. 1915 yılında, üretim kapasitesi yıl ortasına kadar tamamen taahhüt edildi.
Sentezi
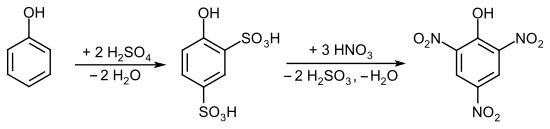
Fenolün aromatik halkası, elektrofilik sübstitüsyon reaksiyonlarına karşı oldukça aktif hale gelir ve seyreltik nitrik asitle bile fenolün nitrolama girişiminde bulunulması, yüksek moleküler ağırlıklı katranların oluşmasına neden olur. Bu yan reaksiyonları en aza indirmek için susuz fenol dumanlı sülfürik asit ile sülfonatlanır ve elde edilen p-hidroksifenilsülfonik asit daha sonra derişik nitrik asit ile nitratlanır. Bu reaksiyon sırasında, yeni gelen nitro grupları, sülfonik asit grubu ile yer değiştirir. Reaksiyon oldukça ekzotermiktir ve dikkatli sıcaklık kontrolü gereklidir.
Pikrik asit sentezinin başka bir yolu, 2,4-Dinitrofenolün nitrik asit ile doğrudan nitrolanmasıdır.[19][20]
Kullanımı
En büyük kulanım alanı, mühimmat ve patlayıcılarda olmuştur. Dunnit olarak da bilinen, Explosive D pikrik asitin amonyum tuzudur—daha yaygın olan patlayıcı TNT'den (pikrik aside benzer bir işlemle ancak hammadde olarak toluen ile üretilir) daha güçlü ancak daha az kararlıdır. Pikrik asidin (tipik olarak Dunnit ile başlar) aminasyonuyla oluşturulan pikramid, oldukça kararlı patlayıcı TATB'yi üretmek için daha fazla aminlenebilir.
Organik bazlar (pikratlar) kristal tuzlarının hazırlanmasında, tanımlama ve karakterizasyon amacıyla organik kimyada bir miktar kullanım alanı bulmuştur.
Metalürjide, "pikral" olarak adlandırılan,etanoldeki %4'lük pikrik asitin dağlayıcı çözeltisi, ferritik çeliklerde önceki östenit tane sınırlarını ortaya çıkarmak için optik metalografide yaygın olarak kullanılmıştır. Pikrik asit ile ilişkili tehlikeler, büyük ölçüde diğer kimyasal dağlayıcılarla değiştirildiği anlamına gelir. Bununla birlikte, AZ31 gibi magnezyum alaşımlarını aşındırmak için hala kullanılmaktadır.
Bouin çözeltisi, histoloji örnekleri için kullanılan pikrik asit içerikli yaygın bir fiksatif çözeltidir.[21] Çözelti, asit boyar maddelerin boyamasını iyileştirse de, bu işlem aynı zamanda örnekteki herhangi bir DNA'nın hidroliziyle de sonuçlanabilir.[22]
Klinik kimya laboratuvar testleri, kreatinini test etmek için kullanılan Jaffe reaksiyonu için pikrik asit kullanır. Spektroskopi kullanılarak ölçülebilen renkli bir kompleks oluşturur.[23]
Pikrik asit, hidrojen siyanür (HCN) ile kırmızı izopurpurat oluşturur. Elde edilen pikrik asitli boyar maddenin fotometrik ölçümü ile hidrojen siyanürün miktar belirlenmesi yapılabilir.[24]
20. yüzyılın başlarında, kan şekeri seviyelerini ölçmek için pikrik asit kullanıldı. Glukoz, pikrik asit ve sodyum karbonat karıştırılıp ısıtıldığında karakteristik bir kırmızı renk oluşur. Kalibre bir glukoz çözeltisi ile, kırmızı renk, eklenen glukoz seviyelerini ölçmek için kullanılabilir. Bu işlem, Lewis ve Benedict glukoz ölçüm yöntemi olarak bilinir.[25]
Çok daha az yaygın olarak, yaş pikrik asit bir cilt boyası veya geçici damgalama maddesi olarak kullanılmıştır. Derideki proteinlerle reaksiyona girerek bir ay kadar sürebilen koyu kahverengi bir renk verir.
20. yüzyılın başlarında, pikrik asit eczanelerde antiseptik olarak ve yanıklar, sıtma, herpes ve çiçek hastalığının tedavisi için bulunduruldu. Pikrik asite batırılmış gazlı bez, yanık tedavilerinde kullanılmak üzere o dönemlerdeki ilk yardım çantalarında sıklıkla bulunduruluyordu. Özellikle 1937'deki Hindenburg felaketinin kurbanlarının çektiği yanıkların tedavisinde kullanıldı. Pikrik asit, I. Dünya Savaşı sırasında Batı Cephesinde konuşlanmış askerlerin çektiği siper ayağı tedavisi içinde kullanıldı.[26]
Pikrik asit, uzun yıllar boyunca sinek bağlayıcılar tarafından olta balıkçılığında cezbedici olarak kullanılan köstebek deri ve tüylerini koyu zeytin yeşili renge boyamak için kullanılmıştır. Popülerliği, pikrik asitin toksik yapısı nedeniyle azalmıştır.
Güvenlik
Modern güvenlik önlemleri, patlama tehlikesini en aza indirmek için pikrik asidin ıslak depolanmasını önerir. Kuru pikrik asit, şok ve sürtünmeye nispeten duyarlıdır, bu nedenle onu kullanan laboratuvarlar, pikrik asiti bir su tabakası altında şişelerde güvenli hale getirerek saklarlar. Pikrik asit, kendisinden daha hassas ve tehlikeli metal pikrat tuzlarını kolaylıkla oluşturabildiğinden muhafazası için cam veya plastik şişeler gereklidir. Endüstriyel olarak pikrik asit özellikle tehlikelidir çünkü uçucudur ve oda sıcaklığında bile yavaşça süblimleşir. Zamanla, açıkta kalan metal yüzeylerde pikratların birikmesi bir patlama tehlikesi oluşturabilir.[27]
Pikrik asitli gazlı bez, antika ilk yardım çantalarında bulunursa, o eski pikrik asit (60-90 yıllık) kristalleşmiş ve kararsız hale gelecek ve metal bir ilk yardım kutusunda uzun süre beklemesi ile metal pikratlar oluşturmuş olabileceğinden dolayı bir güvenlik tehlikesi oluşturur.
Bomba imha ekipleri, kurumuş pikrik asiti imha etmek için sıklıkla çağrılmaktadır.[28][29] Amerika Birleşik Devletleri'nde 1980'lerde lise laboratuvarlarından kurumuş pikrik asit kaplarını uzaklaştırmak için epey bir çaba gösterildi.
Pikrik asit içeren cephaneler batık savaş gemilerinde bulunabilir. Zamanla metal pikratların birikmesi onları şoka duyarlı ve son derece tehlikeli hale getirir. Bu tür mühimmat içeren gemi enkazlarının hiçbir şekilde rahatsız edilmemesi tavsiye edilir.[30] Bu maddeler suda çözünür olduğundan, mermi kovanları deniz suyunu içine alacak kadar aşındığında tehlike azalabilir.[30]
Ayrıca bakınız
Kaynakça
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. s. 691. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0515". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Picric acid". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH).
- ^ Peter Woulfe (1771) "Experiments to shew the nature of aurum mosaicum," 22 Aralık 2016 tarihinde Wayback Machine sitesinde arşivlendi. Philosophical Transactions of the Royal Society of London, 61 : 114-130. See pages 127-130: "Sarı renteki yün ve ipeğin indigo ile ve ayrıca diğer mavi ve kırmızı renklendirici maddelerle boyanması için bir yöntem." ve "Sarı boyar maddeyi yapmak için reçete." — Woulfe’nin indigo ile nitrik asiti işlem yaptığı bölüm.
- ^ Dumas, J. (1841). "Quatrième mémoire sur les types chimiques" [Kimyasal türler üzerine dördüncü anı]. Annales de Chimie et de Physique. 3rd series (Fransızca). 2: 204-232. 7 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2020. Alman kimyager Justus von Liebig pikrik asite Kohlenstickstoffsäure (Fransızca: acide carboazotique) adını vermişti. Ancak, Dumas "pikrik asit" adını önermişti. From p. 228: "C'est sous ce nom que j'ai désigné l'acide carboazotique, … " (Karboazotik asiti bu isimle [yani, pikrik asit] olarak belirledim, … )
- ^ Auguste Laurent (1841) "Sur le phényle et ses dérivés" 24 Şubat 2021 tarihinde Wayback Machine sitesinde arşivlendi. (Fenol ve türevleri hakkında), Annales de Chimie et de Physique, series 3, 3 : 195-228 ; see especially pages 221-228.
- ^ Welter (1799). "Sur quelques matières particulières, trouvées dans les substances animals, traitées par l'acide nitrique" [Hayvansal maddelerde bulunan bazı belirli maddeleri nitrik asitle işleme]. Annales de Chimie et de Physique. 1st series (Fransızca). 29: 301-305. 8 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2020. From p. 303: "Le lendemain je trouvai la capsule tapisée de cristaux dorés qui avoient la finesse de la soie, qui détonoient comme la poudre à canon, et qui, à mon avis, en auroient produit l'effet dans une arme à feu." (Ertesi gün, krozenin içini ipek inceliğinde, barut gibi patlayan altın renkli kristallerle kapIı halde buldum ve bence bu madde ateşli silahta aynı etkiyi yaratır.) Welter pikrik asiti acı tat olarak adlandırdı: from p. 304: " … je nommerai amer." ( … Ona "acı" adını vereceğim.)
- ^ Fransız kimyagerler Fourcroy ve Vauquelin tarafından 1806'da pikrat tuzlarının patlarken neden patladığını açıklayan bir teori Fransız kimyager Chevreul tarafından 1809'da tekrarlandı. Pikrik asit, havanın yokluğunda bile tamamen yanmaya yetecek kadar oksijen içeriyordu - yani "süper oksijenli" (suroxigéné) (Fourcroy and Vauquelin, 1806), p. 543 ; (Chevreul, 1809), p. 129) — (çünkü hava olmadığında bile ısı onu tamamen gaza çevirerek karbon bırakmaz).((Fourcroy and Vauquelin, 1806), pp. 542-543) ; (Chevreul, 1809), pp. 127-128) Ancak pikrik asit yandığında oluşan ısı, asidin bir kısmının buharlaşmasına neden oldu ve o kadar çok ısı yayıldı ki patlama değil sadece yanma meydana geldi. Buna karşılık, pikrat tuzları süblimleşmeyen katılardı, bu yüzden ısıyı dağıtmadılar; dolayısıyla patlattılar.((Fourcroy and Vauquelin, 1806), p. 542) ; (Chevreul, 1809), pp. 129-130) Bkz.:
- Fourcroy; Vauquelin (1806). "Mémoire sur la découverte d'une nouvelle matière inflammable et détonnante, formée par l'action de l'acide nitrique sur l'indigo et les matières animales" [Nitrik asidin indigo ve hayvansal maddeler üzerindeki etkisiyle oluşan yeni bir yanıcı ve patlayıcı maddenin keşfine ilişkin anı]. Mémoires de l'Institute des Sciences et Arts (Fransızca). 6: 531-543. 6 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2020.
- Chevreul (1809). "Extrait d'un mémoire sur les substances amères formées par la réaction de l'acide nitrique sur l'indigo" [Nitrik asidin indigo ile reaksiyona girmesiyle oluşan acı maddeler üzerine bir hatıradan alıntı]. Annales de Chimie et de Physique (Fransızca). 72: 113-142. 8 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2020.
- ^ Not:
- Mart 1871'de, Sprengel, İngiltere'nin Kent kentindeki Faversham'daki John Hall & Sons'un barut imalathanesinde pikrik asidi patlattı.
- Sprengel, 6 Nisan 1871'de (no. 921) ve 5 Ekim 1871'de (no. 2642) "emniyetli patlayıcılar" (yani sabit patlayıcılar) için Britanya'da patent başvurusunda bulundu; son patentte Sprengel, patlayıcı olarak nitrik asitte çözünmüş pikrik asidi kullanmayı önerdi.
- Hermann Sprengel (1873) ""Üretimleri, depolanmaları ve nakliyeleri sırasında patlayıcı olmayan yeni bir patlayıcı sınıfı hakkında"" Journal of the Chemical Society, 26 : 796-808.
- Hermann Sprengel, The Discovery of Picric Acid (Melinite, Lyddite) "As a Powerful Explosive" ... 4 Mart 2021 tarihinde Wayback Machine sitesinde arşivlendi., 2nd ed. (London, England: Eyre & Spottiswoode, 1903). Bu broşür, Sprengel'in pikrik asidi yüksek bir patlayıcı olarak kullanmadaki önceliğini savunduğu (titiz) bir mektup koleksiyonudur.
- ^ a b Brown, G.I. (1998) The Big Bang: a History of Explosives Sutton Publishing 0-7509-1878-0 pp.151-163
- ^ John Philip Wisser (1901). The second Boer War, 1899-1900. Hudson-Kimberly. s. 243. Erişim tarihi: 22 Temmuz 2009.
- ^ Dunnite Smashes Strongest Armor 26 Şubat 2021 tarihinde Wayback Machine sitesinde arşivlendi., The New York Times, August 18, 1907
- ^ Marc Ferro. The Great War. London and New York: Routeladge Classics, p. 98.
- ^ Beck, Bill (2007) Laclede Gas and St. Louis: 150 Years Working Together, 1857-2007, Laclede Gas Company, 978-0-9710910-1-6 p. 64
- ^ Forrestal, Dan J. (1977), Faith, Hope & $5000: The Story of Monsanto, Simon & Schuster, 0-671-22784-X[2] p. 24
- ^ Brandt, E.N. (1997), Growth Company: Dow Chemical's First Century, Michigan State University, 0-87013-426-4 p. 77, 97 and 244
- ^ Brandt, E.N. (1997), Growth Company: Dow Chemical's First Century, Michigan State University, 0-87013-426-4 p. 97
- ^ Conot, Robert (1979), A Streak of Luck: The Life & Legend of Thomas Alva Edison, Seaview Books, NY, p 413-4
- ^ Agrawal, Jai Prakash; Hodgson, Robert (11 Ocak 2007). Organic Chemistry of Explosives (İngilizce). John Wiley & Sons. ISBN 9780470059357. 6 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Eylül 2020.
- ^ Green, Arthur George (1 Nisan 1919). "Manufacture of picric acid. US Patent US1299171A". patents.google.com. 2 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Ağustos 2018.
- ^ Carson, Freida L.; Hladik, Christa (2009). Histotechnology: A Self-Instructional Text (3 bas.). Hong Kong: American Society for Clinical Pathology Press. s. 19. ISBN 978-0-89189-581-7.
- ^ Llewellyn, Brian D (Şubat 2009). "Picric Acid". StainsFile. 31 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Eylül 2012.
- ^ "Creatinine Direct Procedure, on CimaScientific". 6 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Eylül 2020.
- ^ Quantification of total cyanide content in stone fruit kernels. 30 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi. pdf, Pg.33
- ^ 2"Measuring blood glucose levels in the 1920s". Tacomed.com. 16 Aralık 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2017.
- ^ (1922) [1] 25 Şubat 2021 tarihinde Wayback Machine sitesinde arşivlendi. History of the Great War - Surgery of the War, Vol. 1, Pg. 175.
- ^ "JT Baker MSDS". 4 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Eylül 2020.
- ^ "Bomb squad called to Dublin lab". irishtimes.com. Irish Times. 1 Ekim 2010. 22 Ekim 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Temmuz 2011.
- ^ "Unstable chemicals made safe by army". rte.ie. RTÉ News. 3 Kasım 2010. 2 Kasım 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Temmuz 2011.
- ^ a b Albright, p.78
Daha fazla bilgi için
- Albright, Richard (2011). Cleanup of Chemical and Explosive Munitions: Location, Identification and Environmental Remediation. William Andrew.
- Brown, David K.; McCallum, Iain (2001). "Ammunition Explosions in World War I". Warship International. International Naval Research Organization. XXXVIII (1): 58-69. ISSN 0043-0374.
- Cooper, Paul W., Explosives Engineering, New York: Wiley-VCH, 1996. 0-471-18636-8
- CDC - Kimyasal Tehlikeler için NIOSH Cep Rehberi 6 Ağustos 2020 tarihinde Wayback Machine sitesinde arşivlendi.