
Rubidyum, Rb sembolü ile gösterilen, 37 atom numarasına sahip alkali metaller grubundan bir kimyasal element. 1861 yılında Gustav Kirchhoff ve Robert Bunsen tarafından Almanya'da keşfedilmiştir. Kimyasal açıdan potasyum ve sezyumun özelliklerine benzer özellikler gösterir ama potasyuma oranla çok ender bulunur. Oda sıcaklığında gümüşi beyaz renkli, yumuşak ve parlak bir katıdır. Kuru havada bile çok çabuk yükseltgenir, bu yüzden açık havada saklanamaz. Suyu şiddetle ayrıştırır ve ortaya çıkan hidrojeni tutuşturur.

Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Alkol, karbon atomuna doğrudan bir -OH (hidroksil) grubunun bağlı olduğu organik bileşiklere verilen genel ad. Genel formülü CnH2n+1OH olan mono alkoller, alkollerin önemli bir sınıfıdır. Bunlardan etanol (C2H5OH), alkollü içeceklerde bulunan türüdür. Genellikle alkol kelimesi ile etanol kastedilir ki yeni fermente olmuş birada etanol oranı %3-5 arasında iken şarapta %12-15 arasındadır.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.
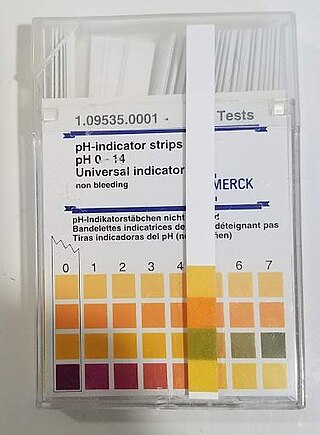
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.

Aseton, propanon ya da dimetil keton, (CH3)2CO formüllü organik kimyasal bileşiktir. Keskin, yanıcı, zehirli olmayan renksiz bir sıvıdır. Çözücü olarak çokça kullanılır. Kapalı formülü C3H6O olarak gösterilir. Su, etanol ve dietil eterle her oranda karışır. Odunun kuru kuruya damıtılmasından, asetat tuzlarının ısıtılmasından ve teknikte izopropil alkolün bakır katalizörlerinden 250 °C'de dehidrojenasyonundan elde edilir. Yağ, boya, kauçuk ve diğer maddelerin çözücüsü olarak kullanılır. Ayrıca izopropil alkol, izopren, kloroform, bromoform, iyodoform ve poli(metil metakrilat) (PMMA) gibi ürünlerin elde edilişinde öncü madde olarak kullanılır. İnsan vücudunda, normal metabolizma ürünü olarak yüksek miktarlarda üretilip atılır.
Kimyasal formül, bir kimyasal birleşiği oluşturan atomlar hakkında detaylı ve açık bilgi veren bir yöntemdir. Moleküler bileşikler için, içindeki elementleri kimyasal sembolleriyle, o elementlerin sayısını da o atomun yanındaki sayılarla belirtirler. Eğer bir molekül, birden çok atom içeriyorsa, bu atomların nicelikleri, yanlarında altyazı olarak belirtilir. İyonik bileşikler ve moleküler olmayan maddeler içinse, atomların girdiği oranlar, bu altyazılarla belirtilir.

Peroksizom, hemen hemen tüm ökaryotik hücrelerde bulunan bir organeldir. Çok uzun zincirli yağ asitlerinin, dallı zincirli yağ asitlerinin, D amino asitlerinin, poliaminlerin katabolizmasında ve memelilerin beyin ve akciğerlerinin normal fonksiyonu için önem taşıyan bir eterfosfolipid olan plazmalojenlerin biyosentezi için gereklidir. Ayrıca enerji metabolizması için önemli olan pentoz fosfat yolundaki iki enzimin toplam aktivitesinin yaklaşık olarak %10'unu içerir. Peroksizomların, hayvanlardaki izoprenoid veya kolesterol senteziyle ilişkili olup olmadığı tartışılmaktadır. Filizlenen tohumlardaki glioksilat döngüsü ("glioksizom"), yapraklardaki fotosolunum, tripanazomatidlerdeki glikoliz ("glikozom") ve bazı mayalardaki metanol veya amin oksidasyonu ile asimilasyonu bilinen diğer peroksizomal işlevlerdir.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.
Biyokimyada, oksidoredüktaz, bir elektronun bir molekülden (indirgenden) bir diğerine aktarılmasını katalizleyen enzimdir. İndirgen için elektron veya hidrojen vericisi olarak da değinilir. Yükseltgen için hidrojen veya elektron alıcısı olarak da değinilir.

Kimyada radikaller eşleşmemiş elektronu olan atom, molekül veya iyonlardır. Bu eşleşmemiş elektronlar genelde son derece reaktiftir. Radikaller, yanma, atmosfer kimyası, polimerleşme, plazma kimyası, biyokimya ve pek çok başka kimyasal süreçte önemli rol oynar. Örneğin, insan fizyolojisinde, süperoksit ve azot oksit, damar tonusu gibi pek çok biyolojik süreci düzenler. Radikal ve serbest radikal terimleri genelde eşanlamlı kullanılmakla beraber, bir radikal bir çözelti kafesi içinde hapsolmuş veya başka bir moleküle bağlanmış durumda olabilir. 1900'de Michigan Üniversitesi'nde Moses Gomberg tarafından betimlenen trifenilmetil radikali, ilk tespit edilmiş organik serbest radikal olmuştur.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Flavin, trisiklik heterosikl izoklooksazin tarafından oluşturulan, pteridine dayanan bir grup organik bileşiğin ortak adıdır. Biyokimyasal kaynak riboflavin vitaminidir. Flavin kısmı genellikle flavin adenin dinükleotidi (FAD) oluşturmak için bir adenosin difosfat ile birleştirilir ve diğer durumlarda, flavin mononükleotidi olarak fosforlanmış bir riboflavin biçimi olarak bulunur. Flavin, flavoproteinlerde protez grubu olarak bulunur.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.
NADPH oksidaz hücre dışı boşluğa bakan zara bağlı bir enzim kompleksidir. Plazma zarında ve ayrıca nötrofil beyaz kan hücreleri tarafından mikroorganizmaları yutmak için kullanılan fagozomların zarlarında bulunabilir. Kompleksin katalitik bileşeninin insan izoformları arasında NOX1, NOX2, NOX3, NOX4, NOX5, DUOX1 ve DUOX2 bulunur.



















