
Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
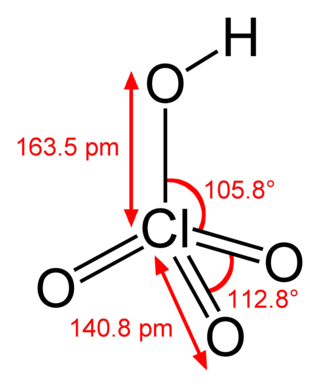
Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.

Kükürtlü asit, sülfüröz asit ya da sülfürik(IV) asit formüllü H2SO3 olan bir kimyasal bileşiktir.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:
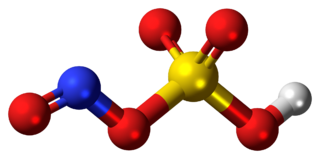
Nitrozilsülfürik asit, NOHSO4 formülüne sahip bir kimyasal bileşiktir. Endüstriyel olarak kaprolaktam üretiminde kullanılan renksiz bir katıdır. Daha önce sülfürik asit üretmek için öncü oda işleminin bir parçasıydı. Bileşik, sülfürik asit ve nitröz asidin karışık anhidritidir.
Titanik asit, genel formül [TiOx(OH)4−2x]n ile titanyum, hidrojen ve oksijen elementlerinin kimyasal bileşiklerinin bir ailesi için genel bir isimdir. Esas olarak eski literatürde çeşitli basit titanik asitler talep edilmiştir. Bu malzemeler için kristalografik ve az spektroskopik destek yoktur. Brauer'in El Kitabı da dahil olmak üzere bazı eski literatür TiO2'den titanik asit olarak söz eder.
- Metatitanik asit (H2TiO3)
- Ortotitanik asit (H4TiO4) "TiO2·2.16H2O" altında beyaz tuz benzeri bir toz olarak tarif edilir.
- Peroksotitanik asit (Ti(OH)3O2H) ayrıca sülfürik asit içindeki titanyum dioksitin hidrojen peroksit ile işlenmesi sonucu da tarif edilmiştir. Elde edilen sarı katı O2 kaybı ile ayrışır.
- Pertitanik asit (H2TiO4)
- Pertitanik asit (TiO(H2O2)2+)

Disülfürik asit veya pirosülfürik asit, kükürtün bir oksoasitidir. Oleumun önemli bir bileşenidir ve çoğu kimyager bu şekilde karşılaşır. Aynı zamanda, dengeye bağlı olarak sıvı susuz sülfürik asidin küçük bir bileşenidir:
- H2SO4 ⇌ H2O + SO3
- SO3 + H2SO4 ⇌ H2S2O7

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Hidrojen bromat olarak da bilinen bromik asit, HBrO3 moleküler formülüne sahip bir oksoasittir. Sadece sulu çözelti içinde bulunur. Broma ayrışırken oda sıcaklığında sarıya dönen renksiz bir çözeltidir. Bromik asit ve bromatlar güçlü oksitleyici ajanlardır ve Belousov-Zhabotinsky reaksiyonlarında yaygın bileşenlerdir. Belousov-Zhabotinsky reaksiyonları denge olmayan termodinamiğin klasik bir örneğidir.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.
Kromik asit terimi genellikle, katı krom trioksit de dahil olmak üzere çeşitli bileşikler içerebilen bir dikromata konsantre sülfürik asit eklenerek yapılan bir karışım için kullanılır. Bu tür kromik asit, cam için bir temizleme karışımı olarak kullanılabilir. Kromik asit ayrıca trioksitin anhidrit olduğu H2CrO4 moleküler türlerine de atıfta bulunabilir. Kromik asit, +6 (veya VI) oksidasyon durumunda krom içerir. Güçlü ve aşındırıcı bir oksitleyici ajandır.

Karbon Yılanı, şekerin konsantre sülfürik asit ile dehidrasyon reaksiyonu gerçekleştirilmesi ile oluşan, genellike kimya derslerinde yapılan deneylerden biridir. Granül sofra şekeri (Sakkaroz) dehidrasyon reaksiyonuna uğrayarak katı-sıvı bir karışıma dönüşür.
Simya çalışmaları sayesinde daha sonra belirli kimyasal bileşikler veya bileşik karışımları olarak sınıflandırılan birçok kimyasal madde üretilmiştir.
















