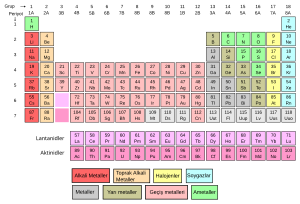
Periyodik tablo, kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur. Dilimizde periyodik tablo, periyodik cetvel, periyodik çizelge, elementler tablosu gibi birçok şekilde isimlendirilmiştir. Bu tablo bilinen bütün elementlerin artan atom numaralarına göre sıralanışıdır. Periyodik cetvelden önce de bu yönde çalışmalar yapılmış olmakla birlikte, mucidi genelde Rus kimyager Dmitri Mendeleyev kabul edilir. 1869'da Mendeleyev atomları artan atom ağırlığına göre sıraladığında belli özelliklerin tekrarlandığını fark etti. Özellikleri tekrarlanan elementleri alt alta yerleştirdi ve buna grup adını verdi.

Element, aynı cins atomlardan oluşan ve kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere verilen isimdir.

Radyoaktivite, radyoaktiflik, ışınetkinlik veya nükleer bozunma; atom çekirdeğinin, daha küçük çekirdekler veya elektromanyetik ışımalar yayarak kendiliğinden parçalanmasıdır. Çekirdek tepkimesi sırasında veya çekirdeğin bozunması ile ortaya çıkar. En yaygın ışımalar alfa(α), beta(β) ve gamma(γ) ışımalarıdır. Bir maddenin radyoaktivitesi bekerel veya curie ile ölçülür.
1. periyot elementi, periyodik tablonun 1. periyodunda yer alan her bir element için kullanılan kavramdır.
2. periyot elementi, periyodik tablonun 2. periyodunda yer alan her bir element için kullanılan kavramdır.
3. periyot elementi, periyodik tablonun 3. periyodunda yer alan her bir element için kullanılan kavramdır.
4. periyot elementi, periyodik tablonun 4. periyodunda yer alan her bir element için kullanılan kavramdır.
5. periyot elementi, periyodik tablonun 5. periyodunda yer alan her bir element için kullanılan kavramdır.
6. periyot elementi, periyodik tablonun 6. periyodunda yer alan her bir element için kullanılan kavramdır.
7. periyot elementi, periyodik tablonun 7. periyodunda yer alan her bir element için kullanılan kavramdır. 7. periyotta bulunan tüm elementler radyoaktiftir. Yerkabuğunda bulunan en ağır element olan uranyum bu periyottadır.
Alkali metaller periyodik tablonun birinci grubunda yer alan metallerdir. Fransiyum dışında hepsi, yumuşak yapıda ve parlak görünümdedir.
Platin grubu metaller. periyodik cetvelde, altı element için kullanılan bir gruplandırmadır. Bu elementlerin tümü geçiş metallerinden olup d blokunda yer alırlar.

İterbiyum (Yb), sembolü ile bilinen, elektron dizilişlerinde f orbitalinde elektron barındıran kimyasal bir element. Bu element grup 3 elementlerine ve 6. periyot elementlerine ait olan bir lantanittir.

Paladyum, Pd işaretiyle bilinen, platine benzer, atom no: 46 ve atom ağırlığı: 106.42 olan kimyasal element. 1803'te William Hyde Wollaston tarafından bulunan Kıymetli metallerden sayılır. Paladyum metali gruptaki metallerin en değerlisidir. Beyaz altın elde edilmesinde kullanılır. 21.09.2020 itibarıyla fiyatı 2,337.50$ ons'dur.
Kimyasal formül, bir kimyasal birleşiği oluşturan atomlar hakkında detaylı ve açık bilgi veren bir yöntemdir. Moleküler bileşikler için, içindeki elementleri kimyasal sembolleriyle, o elementlerin sayısını da o atomun yanındaki sayılarla belirtirler. Eğer bir molekül, birden çok atom içeriyorsa, bu atomların nicelikleri, yanlarında altyazı olarak belirtilir. İyonik bileşikler ve moleküler olmayan maddeler içinse, atomların girdiği oranlar, bu altyazılarla belirtilir.

Periyodik cetveldeki farklı periyotta ve gruptaki iki element arasındaki benzerliklere çapraz ilişki denir. Bu benzerliklerin nedeni ise; bu elementlerin katyonlarının yük yoğunluklarının yakınlığıdır.

Atom yarıçapı, küre şeklinde olduğu düşünülen atomların büyüklüklerini ölçmekte kullanılan bir niceliktir. Bu nicelik bir atomun çekirdeği ile elektron bulutu arasındaki uzaklığı ifade eder.

Alev ya da yalım, ateşin gözle görünen plazmalı bölümüdür.

Genişletilmiş periyodik tablo, atom numarası 118'den büyük olan kimyasal elementlerin periyodik tabloya kaydedilebilmesini sağlar. Bu tablo 8'inci ve 9'uncu periyotları kapsar. Böyle bir tablo 1969'da Glenn T. Seaborg tarafından önerilmiştir. Standart periyodik tablonun, keşfedilmemiş elementleri kapsamak için ortaya konmuş bir uzantısıdır. Yeni periyotlar tam olarak 7. periyodun "kopyaları" değil, içinde bir de g orbitali ile eklenen 18 elementi kapsayan bir de "g blokuna" sahiptirler.
Titanyum grubu veya 4. grup periyodik tabloda yer alan bir kimyasal elementler grubudur. Modern IUPAC adlandırma sistemine göre periyodik tablonun 4. grubu titanyum (Ti), zirkonyum (Zr), hafniyum (Hf) and rutherfordiyum (Rf) elementlerini kapsar. Grup periyodik tablonun d bloku içinde yer alır. 4. grupta yer alan üç element titanyum (Ti), zirkonyum (Zr) ve hafniyum (Hf) doğal olarak bulunur buna karşın rutherfordiyum (Rf) radyoaktiftir. Rutherfordiyumun bütün izotopları radyoaktiftir ve laboratuvarda üretilirler, hiçbiri doğada bulunmaz. Şimdiye kadar süperçarpıştırıcılarda yapılan hiçbir deneyde grubun bir sonraki üyesi Unpentkuadyum (Upq) elemtinin sentezi gerçekleştirilemedi. 8. periyot elementlerinin sonlarında yer alan üyelerinden biri olduğundan Upq elementinin yakın bir gelecekte sentezlenmesi pek mümkün görünmemektedir.