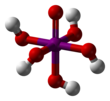
Karbondisülfür, formülü CS2 olup, yanabilen, hemen hemen renksiz olan, oldukça zehirli bir sıvı. Genel kanıya göre inorganik bileşik olarak kabul edilir. Ticari karbondisülfürün kokusu safsızlık kaynaklı olup, çürük lahana veya yumurta kokusuna benzerken saf karbondisülfürün kokusu etere benzer. Karbondisülfür -108,6 °C'de donar, 46,3 °C'de kaynar. Yoğunluğu 1,261 g/cm³'tür. Suda az çözündüğü hâlde alkol, eter ve karbon tetraklorürde çok çözünür.

Arsin AsH3 formüllü inorganik bileşik. Bu yanıcı ve fazlaca zehirli gaz, arsenik elementinin en basit bileşiklerinden biridir.

Küprik sülfat ya da sadece bakır sülfat olarak da bilinen Bakır (II) sülfat, kimyasal formülü CuSO4 olan bir kimyasal bileşiktir. Bu tuzun hidrasyon derecelerine bağlı olarak bir dizi farklı bileşikleri mevcuttur. Susuz formu soluk yeşil ya da grimsi beyaz bir toz olmasına karşın en çok bilinen pentahidrat (CuSO4•5H2O) formu, parlak mavi renktedir. Çok az miktardaki CuSO4•5H2O çevreye çok zehirlidir, gözleri ve cildi tahriş eder ve yutulduğunda zararlı da olabilir. Oktahedral moleküler geometriye ve paramanyetik özelliğe sahip olan bakır (II) sülfat ekzotermik olarak suda çözünürek [Cu(H2O)6]2+ kompleksini oluşturur. Bakır (II) sülfat "mavi vitriyol", "göztaşı" ve "göktaşı" olarak da bilinmektedir.

Lityum bromür (LiBr) lityum ve bromun bir bileşiği.Ekstrem higroskopik karakteri LiBr'yi son iklimlendirme sistemlerinde nemçekici olarak kullanılması açısından kullanışlı hale getirmiştir.

Azot pentaoksit N2O5 formüllü kimyasal bileşik. Diazot pentaoksit olarak da bilinir. Sadece azot ve oksijen içeren azot oksit ailesinin ikili bileşiklerinden biridir. Kararsız ve potansiyel oksitleyicidir.

Azot triklorür, trikloramin olarak da bilinen formülü NCl3 olan kimyasal bileşik. Sarı, yağımsı, keskin kokulu bir sıvıdır. En sık amonyak türevleri ve klor arasındaki kimyasal reaksiyon sonrası oluşmaktadır, yüzme havuzlarındaki oluşumu buna bir örnektir.

Perksenatlar, ksenonun oluşturduğu XeO4-6 anyonunu içeren tuzlardır. Bu tuzlar, Raman saçılmasıyla belirlenen sekiz yüzlü moleküler geometri yapısına sahip olup oksijen-ksenon-oksijen bağ açıları 87° ile 93° arasında değişkenlik gösterir. Ksenon ile oksijen arasındaki bağın uzunluğu ise X ışını kristalografisi tarafından 1,875 Å olarak belirlenir.

Hipoiyodöz asit, HOI kimyasal formülü ile gösterilen inorganik bir bileşiktir. Sulu bir iyot çözeltisinin cıva veya gümüş tuzları ile işlenmesi durumunda oluşur. Disproporsiyonlaşma ile hızla ayrışır:
- 5 HOI → HIO3 + 2I2 + 2H2O

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.
Hiponitröz asit, H2N2O2 veya HON=NOH formülüne sahip kimyasal bir bileşiktir. Bir nitramid, H2N−NO2 izomeridir.
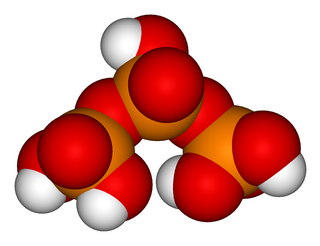
H5P3O10 formülüne sahip trifosforik asit (ayrıca tripolifosforik asit), yoğunlaştırılmış bir fosforik asit formudur. Fosforik asitler ailesinde, pirofosforik asitten sonra da difosforik asit olarak da adlandırılan H4P2O7'den sonraki bir sonraki polifosforik asittir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.
Disülfür diklorür S
2Cl
2 formüllü kükürt ve Klor bileşiğidir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.
Polihalojen iyon, yalnızca halojenlerde bulunan bir grup çok atomlu katyon ve anyonlardır. Yalnızca tek tür halojen içeren izopolihalojen iyonları ve birden fazla tür halojen içeren heteropolihalojen iyonları olmak üzere iki gruba ayrılır.
 H5IO6
H5IO6 H4IO-6 + H+, pKa = 3.29
H4IO-6 + H+, pKa = 3.29 H3IO2-6 + H+, pKa = 8.31
H3IO2-6 + H+, pKa = 8.31 H2IO3-6 + H+, pKa = 11.60
H2IO3-6 + H+, pKa = 11.60